微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 氨气在工农业生产中有重要的用途。某校甲、乙两个化学小组分别对氨的相关实验进行了研究。

(1)甲、乙两小组选择了不同方法制取氨气,
请将实验装置的字母编号和制备原理填写在下表空格中。
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、氯化铵
| 反应的化学方程式为
①???????????????????????????????
|
乙小组
| ②
| 浓氨水、氢氧化钠
| 用化学平衡原理分析氢氧化钠的作用:
③???????????????????????????????
?
(2)甲组通过右图装置(尾气处理装置已略去)验证了氨有还原性,装置中的实验现象是____???????????????????????????????????????,硬质玻璃管中氨发生催化氧化反应的化学方程式为?????????????????????????。
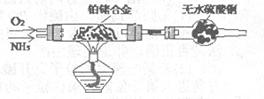
(3)甲组将足量氨气不断通入滴有酚酞的AgNO3溶液中,现象为??????????????????????,
反应结束所得溶液中除了H+、OH-、NH4+外还主要含有的离子有????????????????????。
(4)乙组欲制备氮化镁,查阅资料发现氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由?????????????????????????????????????。 3Cu+N2+3H2O),而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水立即反应生成Mg(OH)2和NH3。乙组提出了如下制备氮化镁的实验方案示意框图(实验前系统内空气已排除;图中箭头表示气体的流向)。你认为此方案是否正确,并说明理由?????????????????????????????????????。
2、填空题 氧分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆的功能,而成为当前生命科学的研究的热点。NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于_________(填编号)。
A.破坏臭氧层
B.高温下能使一些金属被氧化
C.造成酸雨
D.与人体血红蛋白结合
(2)在含Cu+(亚铜离子)的酶的活化中心,亚硝酸根离子可转化为NO,写出Cu+和亚硝酸根离子在酸性水溶液中反应的离子方程式______________________________________
(3)在常温下,把NO气体压缩到100大气压,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力2/3就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式_________________.
(4)解释变化(3)中为什么最后气体总压力小于原压力的2/3?__________________________.
(5)NO成为“臭名昭著的明星分子”所包含的哲学原理是_____________________________
3、选择题 铁与稀HNO3反应时,若消耗的Fe与HNO3的物质的量之比为4:10,且只生成Fe2+,则反应中生成的还原产物是(???)????????????????????????????????????????????????????????????????????????????????????????
A.N2
B.NO2
C.NO
D.N2O
4、选择题 下列现象中不属于铵盐分解的是(???)
A.在试管里加热NH4Cl固体可发生“升华”现象
B.NH4HCO3化肥最好密封保存
C.敲击NH4NO3固体会发生爆炸
D.将NH4Cl和Ca(OH)2固体共热会产生NH3
5、填空题 在通常状况下,NO2和SO2很容易发生反应生成NO和SO3,该反应为不可逆反应。现将NO和SO2的混合气体通入容积为100 mL的容器中,充满后,用带有导管的塞子?密封。??
(1)向容器中通入O2的体积,x在 数值范围内才能保持容器内的压强不变。?
(2)要使容器内只含有NO2和SO3两种气体,必须通入O2? ? mL。?
(3)若向容器中通入40 mL O2后才开始出现红棕色,且不褪色,则原混合气体中NO的体积为 mL(气体体积均在同温、同压下测定,此时SO3为气体,且不考虑2NO2 N2O4的反应)。? N2O4的反应)。?
|