微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某实验小组同学探究铜与硝酸的反应。
(1)用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10 mL硝酸溶液分别与铜片反应,实验记录如下:
序号
| 浓硝酸与水的体积比
| 实验现象
|
Ⅰ
| 1:1
| 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色
|
Ⅱ
| 1:3
| 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色
|
Ⅲ
| 1:5
| 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色
?
铜与稀硝酸反应的离子方程式为?????????;若生成标准状况下0.56 L NO气体,反应中被还原的HNO3的质量为?????????g(小数点后保留两位有效数字)。
依据上表,制备NO气体最适宜的是实验II,理由是?????????。
(2)为防止有毒气体逸散造成空气污染,该小组同学改进实验装置,如右图所示(夹持仪器略去)。
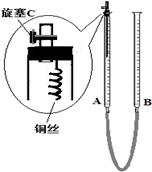
用该装置进行铜与稀硝酸的反应并验证产生NO气体的性质,实验步骤如下:
Ⅰ.安装好装置后,检查装置气密性。
Ⅱ.打开旋塞C,从B管上端加入所选浓度的硝酸,至铜丝下沿(不接触铜丝)。
Ⅲ.向上移动B管,使A管液面上升至与橡皮塞恰好接触,关闭旋塞C,反应开始。
Ⅳ.当液面重新下降至与铜丝脱离接触时,反应停止。
Ⅴ.打开旋塞C,向下移动B管,使A中迅速进入少量空气,关闭旋塞C,观察现象。
……
①步骤Ⅰ中检查装置气密性的操作是:关闭旋塞C,从B管上端加入水,若观察到?????????,说明装置的气密性良好。
②步骤Ⅲ操作的目的是?????????。
③为使A管内的NO气体完全被溶液吸收,可进一步采取的操作是?????????,能确定NO完全被溶液吸收的现象是?????????。
2、选择题 下列四组混合气体体积比为
①NO2:O2=2:1②NO:O2=2:1③NH3:O2=2:1④NO2:NO:O2=1:1:1,将分别盛满上述各种气体的容积相等的四支试管倒置于盛有水的水槽中,最后试管内液面由低到高顺序正确的是(??)
A.④③②①
B.④①②③
C.③①④②
D.③②①④
3、填空题 雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
⑴As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,该反应的化学方程式为 。
⑵上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
⑶As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 极附近逸出。
⑷将⑶中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为 (设该条件下的气体摩尔体积为23.8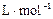 ,结果保留到小数点后三位)。 ,结果保留到小数点后三位)。
4、计算题 在硝酸生产过程所排放出来的废气中含有NO和NO2,它们污染环境,现用氨催化还原法将它们转化为无毒气体(填名称)____直接排入空气中,写出有关反应方程式:__???????????????? __,假设NO和NO2物质的量之比恰好为1∶1,则两者的混合物相当于一种酸酐,写出由烧碱溶液吸收这种酸酐的化学方程式:___????????? _。
5、填空题 (9分)(1)实验室用氢氧化钙和氯化铵加热制氨气的化学反应方程式为:
__________________________________________________________________
实验室制取氯气的化学反应方程式为????????????????????????????? ??? ???
(2)若将标准状况下收集到的672 mL的氨气,溶于水配成100 mL的溶液,则氨水中NH3物质量浓度(不考虑NH3与H2O的反应)为:___________________mol·L-1。
|