微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫——碘循环分解水制氢主要涉及以下反应
I??? SO2+2H2O+I2=H2SO4+2HI
II?? 2HI H2+I2
H2+I2
III? 2H2SO4=2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是__________
a.反应III易在常温下进行??????? b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O????????d.循环过程中产生1mol O2的同时产生1 molH2
(2)一定温度下,向1L密闭容器中加入1 molHI(g),发生反应II,H2物质的量随时间的变化如图所示。
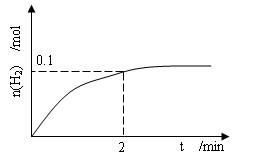
0—2min已见分晓的平均反应速率v(HI)=_____________,该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=__________。
2HI(g)的平衡常数K=__________。
相同温度下,若开始加入2HI(g)的物质的量是原来的2倍,则_____是原来的2倍。
a.平衡常数??? b.HI的平衡浓度??? c.达到平衡的时间??? d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制H2,反应时候溶液中水的电离平衡________移动(填“向左”或“向右”或“不”);若加入少量下列试剂中的__________,产生H2的速率将增大。
A.NaNO3
B.CuSO4
C.Na2SO4
D.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知? 2H2(g)+O2(g)=2H2O(1)????△H=-572kj·mol-1
某氢氧燃料电池释放228.8kj电能时,生成1mol液态水,该电池的能量转化率为????? ???。
???。
2、选择题 aW3+、bX+、cY2-、dZ-是四种短周期元素的离子,它们具有相同的电子层结构,则下列说法正确的是 [???? ]
A.四种元素位于同一周期
B.氢化物的稳定性:H2Y>HZ
C.离子的氧化性:aW3+>bX+
D.a+3=c-2
3、选择题 下列有关比较中,错误的是
A.热稳定性:NH3>PH3>H2S
B.熔点:石英>食盐>冰
C.酸性:醋酸>碳酸>苯酚
D.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH) 3胶体>FeCl3溶液
4、选择题 元素周期表中前七周期元素的种类如下

请你寻找规律,预言第8周期最多可能包含的元素种类为 [???? ]
A.18种
B.32种
C.50种
D.64种
5、选择题 下列叙述正确的是
A.同周期元素ⅦA族元素的原子半径最大
B.ⅥA族元素的原子,其半径越大,越容易得到电子
C.室温时,零族元素的单质都是气体
D.第ⅠA族中全是金属元素