微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 甲、乙、丙三种物质之间有如下转化关系
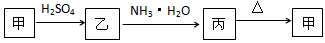
(1)若乙溶液中加入KSCN溶液,有血红色出现,则甲物质是:_____________。写出“甲→乙”转化的离子方程式:________________________。
(2)若甲是不溶于水的白色粉末状物质,既能溶于盐酸又能溶于氢氧化钠溶液,则乙是___________。写出“乙→丙”转化的离子方程式:___________________________。
参考答案:(1)Fe2O3;Fe2O3+6H+==2Fe3++3H2O
本题解析:
本题难度:一般
2、实验题 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
探究内容
| 实验方案
| 实验现象
|
探究Fe2+具有还原性
| 取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________
| 溶液变成血红色
|
探究Fe2+具有氧化性
| 取少量0.1 mol·L-1 FeCl2溶
液,加入_________充分
反应
| 溶液由浅绿色变无色
所发生反应离子方程式为________________
?
参考答案:(1)① 本题解析: 本题解析:
试题分析:(1)铁常见的化合价就只有三种:零价、正二价、正三价;金属铁还原三价铁离子成二价铁离子就是一个三种化合价的铁都有的铁的反应方程式;
(2)还原性的检验是用氯水来氧化二价铁离子,氧化性的检验是用多属单质来还原三价铁离子。
本题难度:一般
3、实验题 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有?????????????????????、?????????????????.(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是________________(填写序号)。
①未洗涤烧杯和玻璃棒????????????????????????????
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水?
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入氯水发生的离子方程式??????????????????????????????????????????,
(4)检验沉淀是否已经洗涤干净的操作是????????????????????????????????????????。
(5)若原样品质量a为50g,加热后红棕色固体质量b为3g,则样品中铁元素的质量分数是??????????????????。
参考答案:(1)250mL容量瓶(1分)、胶头滴管(1分)
(
本题解析:
试题分析:(1)由图可知,操作I是将加入盐酸反应的溶液稀释成250.00mL溶液,故需要250mL容量瓶、胶头滴管;
(2)①④偏小,②偏高;③无影响
(3)加氯水就是让+2价铁变为+3价,发生反应为2Fe 2++Cl2=2Fe 3++2Cl-;
(4)洗涤的是氢氧化铁沉淀,溶液中是氯化铵溶液,可以检验Cl-看沉淀是否洗涤干净。取最后一次洗涤液,滴加滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净。
(5)从250ml溶液中取25ml溶液试验得到红棕色固体质量b为3g,则原
本题难度:一般
4、填空题 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
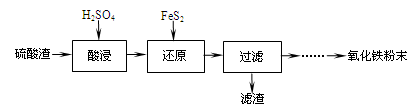
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②????????????。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
?????????????????????????????????????????????????????????????。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量???????????(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量???????????????。
(4)①可选用?????????????(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
?????????????????????????????????????????????(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Al(OH)3
| Fe(OH)2
| Mg(OH)2
| Mn(OH)2
| 开始沉淀
| 2.7
| 3.8
| 7.5
| 9.4
| 8.3
| 完全沉淀
| 3.2
| 5.2
| 9.7
| 12.4
| 9.8
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化:??????????????????????????????;
b. 沉淀:???????????????????????????????;
c. 分离,洗涤;???????????? d. 烘干,研磨。
参考答案:(1)抑制Fe3+的水解?(1分)
(2)14Fe3+
本题解析:
试题分析:试题分析:(1) 酸浸”中硫酸要适当过量,抑制Fe3+的水解;
(2)由信息Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,在利用氧化还原反应配平方程式:14Fe3++FeS2+8H2O ===15Fe2++2SO42—+16H+;
(3)①若SnCl2不足量,Fe3+没有完全还原为Fe2+,则测定的Fe3+量偏低,②若不加HgCl2,溶液中含有Sn2+,也可以被酸性高锰酸钾氧化,消耗的酸性高锰酸钾氧化偏大,则测定的Fe3+量偏高。
(4)①检验滤液中含有Fe3
本题难度:一般
5、填空题 王老师在用酒精喷灯做“铁与水蒸气反应”后,该校高一化学研究性小组同学对得到的黑色固体物质进行了如下实验:

(1)甲同学认为:该黑色固体为四氧化三铁。请写出黑色固体溶于稀盐酸的化学方程式____________;
(2)乙同学提出:根据上述实验现象甲同学的观点不可靠,理由是__________;
(3)深红色溶液C放置一段时间后,发现红色褪去。关于溶液褪色的原因,同学们纷纷猜想:
假设一:氯水有强氧化性,将溶液中的SCN—氧化;
假设二:空气中有还原性物质,将???????????????????????;
假设三:氯水有极强的氧化性,将???????????????????????;
基于假设一,为验证合理与否,可选用试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1NaOH、0.lmol·L-1FeC13、0.lmol·L-1 CuSO4、20%KSCN、蒸馏水。
实验操作
| 预期现象
| 结论
| 取少量褪色后的溶液,????
| ?????????????????????????
| 说明假设一是合理的
?
(4)乙同学用酒精灯加热做铁与水蒸气反应的实验,也得到了黑色固体,它不能被磁铁吸引,当加入盐酸溶解该固体时,溶液呈浅绿色,再滴加KSCN溶液不变色。由此她认为生成该固体的化学方程式为???????????????????。
参考答案:(1)Fe3O4+8HCl=2FeCl3+FeCl2+4H2
本题解析:(1)四氧化三铁可以写作Fe2O3·FeO,所以四氧化三铁与盐酸反应的化学方程式为Fe3O4+8HCl=2FeCl3+FeCl2+4H2O。
(2)由于该黑色固体不一定只是Fe3O4,当黑色固体是Fe3O4和FeO,或Fe3O4和Fe,或Fe3O4、FeO时,也都有上述现象,所以结论是不准确的。
(3)溶液显红色,是因为Fe3+离子与SCN-反应而显色。如果红色逐渐褪色,则可能的原因是氯水有强氧化性,将溶液中SCN-氧化;或者空气中有还原性物质,将溶液中Fe3+还原为Fe2+;或者氯水有极强的
本题难度:困难
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772