微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用CH4催化还原 NOx可以消除氮氧化物的污染。例如:
① CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一574kJ·mol-1?②CH4 ( g ) + 4NO ( g ) = 2N2 ( g ) + CO2 ( g ) + 2H2O ( g ) ;△H=一1160kJ·mol一1下列说法不正确的是
A.由反应①可推知:CH4 ( g ) + 4NO2 ( g ) =" 4NO" ( g ) + CO2 ( g ) + 2H2O ( l) ;
△H>一574 kJ·mol-1
B.反应①②转移的电子数相同
C.若用标准状况下 4.48LCH4还原 NO2至 N2,放出的热量为 173.4kJ。
D.若用标准状况下 4.48LCH4还原 NO2至 N2,整个过程中转移的电子总数为1.60 mol
参考答案:A
本题解析:A与①比较生成水的状态不同,生成液态水放出的热量多,所以△H<一574kJ·mol-1 ;由电子转移可知反应①和②转移的电子数相同。CH4还原 NO2至 N2,可得方程式为:
CH4(g) + 2NO 2 (g)="=" N2 (g) + CO2 (g) + 2H2O(g);△H=-867kJ·mol-1,所以4.48LCH4转移电子数为1.60mol,放出的热量为173.4kJ。
本题难度:一般
2、填空题 氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。
(1)现有8.4克氧化铜被氢气完全还原后,得到红色固体6.96克,其中含单质铜与氧化亚铜的物质的量之比是???????????????;
(2)若将6.96克上述混合物与足量的浓硝酸充分反应:
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是?????????,其物质的量之比是????????????;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体20.328g。经分析,原溶液中的Cu2+有20%残留在母液中,所得晶体的化学式为???????????????????。
(3)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L HNO3溶液恰好使混合物完全溶解,同时收集到224mL NO气体(标准状况)。如原混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围(写出解题过程)。
参考答案:(1)5∶1
(2)①NO、NO2,(1分) 11∶
本题解析:
试题分析:(1)设单质铜与氧化亚铜的物质的量分别为x和y,则根据铜原子守恒可知x+2y= =0.105mol。又因为64g/mol×x+144g/mol×y=6.96g,解得x=0.075mol、y=0.015mol,因此单质铜与氧化亚铜的物质的量之比为5∶1。
=0.105mol。又因为64g/mol×x+144g/mol×y=6.96g,解得x=0.075mol、y=0.015mol,因此单质铜与氧化亚铜的物质的量之比为5∶1。
(2)①反应中转移电子的物质的量为0
本题难度:一般
3、选择题 R2O8n-离子在一定条件下可把Mn2+氧化成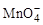 ,若反应后
,若反应后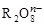 变成
变成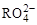 ,且反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-中R元素的化合价以及n分别为
,且反应中氧化剂与还原剂的离子个数比为5:2,则R2O8n-中R元素的化合价以及n分别为
A.+7,2
B.+6,2
C.+5,1
D.+4,1
参考答案:A
本题解析::
试题分析:R2O8n-中R化合价为+(8- ),Mn2+是还原剂,R2O8n-是氧化剂,根据得失电子相等得:5×2×(8-
),Mn2+是还原剂,R2O8n-是氧化剂,根据得失电子相等得:5×2×(8- 本题难度:一般
本题难度:一般
4、选择题 在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH-=RO4-+2F-+H2O,从而可 知在RO3n-中,元素R的化合价是?
[?????]
A.+4价
B.+5价
C.+6价
D.+7价
参考答案:B
本题解析:
本题难度:简单
5、计算题 用15.8g KMnO4氧化75mL足量浓盐酸。反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O
(1)有多少克HCl被氧化?
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度?
参考答案:(1)18. 25g (2)12mol·L-1
本题解析:略
本题难度:简单