微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从海水中可以提取溴,主要反应为:2Br—+Cl2 = Br2+2Cl—,下列说法正确的是
A.Br2是氧化产物
B.氯气是还原剂
C.氯气是氧化剂
D.该反应属于复分解反应
参考答案:AC
本题解析:略
本题难度:简单
2、选择题 下列有关海水综合利用的说法不正确是
A.可用蒸馏或离子交换等方法淡化海水
B.海水提溴只涉及物理变化
C.利用海水可以制取金属Mg
D.开发海洋资源不能以牺牲环境为代价
参考答案:B
本题解析:
试题分析:海水中盐的沸点高,水的沸点较低,因此可以用蒸馏海水的方法制取蒸馏水,也可以用离子交换的方法除去海水中的阴阳离子,制取淡水,A项正确;海水中溴元素以-1价形式存在,Br2中溴元素以0价形式存在,则海水提溴一定有新物质生成,一定涉及化学变化或氧化还原反应,B项不正确;海水中含有+2价的镁元素,通过分离提纯可以制备无水MgCl2固体,由于镁是活泼金属,可以用电解熔融MgCl2的方法制取单质镁和氯气,C项正确;开发海洋资源时要保护环境,不能破坏环境,D项正确。
本题难度:简单
3、选择题 某同学设计实验从海带中提取碘:①滴加稀硫酸和双氧水;②在海带中加入少量酒精,点燃使其燃烧为灰烬,在灰烬中加水搅拌;③加四氯化碳并振荡;④过滤;⑤分液。该实验的合理操作顺序是(??)
A.①③⑤②④
B.②①③④⑤
C.②④①③⑤
D.③①②⑤④
参考答案:C
本题解析:设计原理是使海带中的I-变成碘单质,再用萃取分液的方法分离。反应原理:2H++2I-+H2O2=I2+2H2O。
本题难度:一般
4、选择题 能源家族成员:①石油 ②电力 ③风能 ④天然气 ⑤水煤气 ⑥氢能, 其中属于二次能源的有
A.①③⑥
B.②④⑤
C.①③④
D.②⑤⑥
参考答案:D
本题解析:
试题分析:(1)一次能源是指直接取自自然界没有经过加工转换的各种能量和资源,它包括:原煤、原油、天然气、核能、太阳能、水力、风力、波浪能、潮汐能、地热、生物质能和海洋温差能等等;(2)由一次能源经过加工转换以后得到的能源产品,称为二次能源,例如:电力、蒸汽、煤气、汽油、柴油、重油、液化石油气、酒精、沼气、氢气和焦炭等等,因此答案选D。
本题难度:一般
5、填空题 (12分)工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
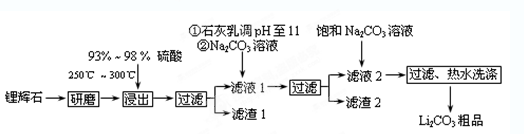
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓)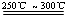 Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
T/℃
| 20
| 40
| 60
| 80
|
S(Li2CO3)/g
| 1.33
| 1.17
| 1.01
| 0.85
|
S(Li2SO4)/g
| 34.2
| 32.8
| 31.9
| 30.7
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中最佳反应的离子方程式是____________________________。
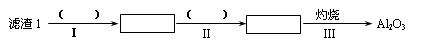
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是? ???。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
②b中,生成Li2CO3反应的化学方程式是______________________________。
参考答案:(1)Al3++3NH3·H2O=Al(OH)3↓+3NH4
本题解析:(1)滤渣I中含有氧化铝和二氧化硅,由于二者都和氢氧化钠反应,所以要除去二氧化硅,应该用盐酸溶解氧化铝。过滤后向滤液中通入氨气即生成氢氧化铝沉淀,方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+。
(2)石灰乳中存在平衡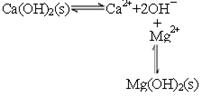 ,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg ,由于镁离子结合OH-,生成更难溶的氢氧化镁,平衡右移,沉淀转变为Mg
本题难度:一般
|