微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 化学兴趣小组在实验中发现:将锌粒放入CuSO4溶液中一段时间,锌粒表面附着了一层松散的黑色粉末状物质,而不是预期的红色物质。通过查阅资料和讨论,大家认为黑色物质可能由Cu、CuO和Zn组成。同学们决定对黑色物质进行探究。
Ⅰ.小组成员认为黑色物质中含有氧化铜,是反应过程中生成了Cu(OH)2分解产生的。请说明反应过程中产生Cu(OH)2的原因:_________________。
Ⅱ.兴趣小组对黑色粉末状物质的组成进行了实验探究。请完成下列实验报告限选实验仪器与试剂:
1 g黑色粉末、试管、玻璃棒、药匙、滴管、酒精灯、试管夹、稀H2SO4、 浓HNO3、稀NaOH溶液、蒸馏水
实验报告
(1)实验课题:探究黑色粉末的组成
(2)设计实验方案
(3)实验过程

(4)实验讨论:根据以上探究结果,如果要在锌与CuSO4溶液的反应中获得预期的红色物质,改进的方法是__________________。
参考答案:ⅠCu2++2H2O![]() 本题解析:
本题解析:
本题难度:一般
2、选择题 能够用来鉴别BaCl2、NaCl、Na2CO3三种物质的试剂是( )
A.AgNO3溶液
B.稀硫酸
C.稀盐酸
D.稀硝酸
参考答案:A、BaCl2、NaCl、Na2CO3与AgNO3溶液反应都
本题解析:
本题难度:一般
3、填空题 (14分)
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号
| 实验目的
| 碳粉/g
| 铁粉/g
| 醋酸/%
|
①
| 为以下实验作参照
| 0.5
| 2.0
| 90.0
|
②
| 醋酸浓度的影响
| 0.5
| ?
| 36.0
|
③
| ?
| 0.2
| 2.0
| 90.0
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了?????????????腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了??(“氧化”或“还原”)反应,其电极反应式是???????????????????????????????????。
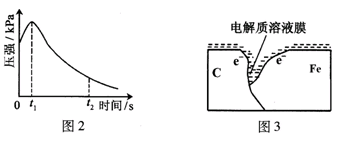
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:??????????????????????????????;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
实验步骤和结论(不要求写具体操作过程):
参考答案:
(1)②2.0??③碳粉含量的影响
(2)吸氧
本题解析:
试题分析:(1)探究影响化学反应速率,每次只能改变一个变量,故有②中铁的量不变,为2.0g;③中改变了碳粉的质量,故为探究碳粉的量对速率的影响。
(2)压强与气体的物质的量成正比,从图中可以看出,气体的量开始增加,后减少,故为吸氧腐蚀;活泼金属做负极,故碳为正极,发生还原反应。
(3)从体积的影响因素着手,温度升高,体积增大
(4)基于假设一,可知,产生氢气,发送那些变化,从变化入手考虑
本题难度:一般
4、实验题 (本题共12分)
下图是某化学兴趣小组进行丁烷裂解的实验流程。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略铁架台等。)按下图连好装置后,需进行的实验操作有:①给D、G装置加热;②检查整套装置的气密性;③排出装置中的空气等……
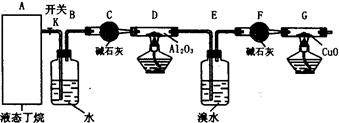
(1)这三步操作的先后顺序依次是????????(写编号);
(2)简要说明排空气的方法和证明空气已排尽的方法???????????????;
(3)B装置所起的作用是?????????????????;
(4)假定丁烷按C4H10→C2H6+C2H4和C4H10→CH4+C3H6的方式完全裂解,当(E+F)装置的总质量比反应前增加了0.7g,G装置的质量减少了1.76g,则丁烷的裂解产物中,甲烷与乙烷的物质的量之比为???????????。(假定流经D、G装置中的气体能完全反应)
若对E装置中的混合物再按以下流程实验:
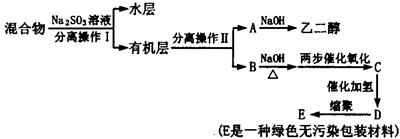
(5)分离操作Ⅰ和Ⅱ的名称分别是:Ⅰ??????Ⅱ?????,Na2SO3溶液的作用是(用离子方程式表示)?????????????????。?
(6)D的结构简式是???????????????。
参考答案:(1)②③①?????
(2)打开开关K,利用丁烷气体
本题解析:(1)装置连接好以后。首先检验气密性,所以顺序是②③①。
(2)根据装置可知,可利用丁烷来排尽装置中的空气,丁烷是可燃性气体,通过检验丁烷来检验是否排尽空气,即打开开关K,利用丁烷气体排出空气;用小试管在G装置后收集一试管气体,移近火焰上方,若只能听到极轻微的爆鸣声,表明空气基本排尽。
(3)B中是水,所以可以通过观察气泡的来控制气体的流速,从而控制丁烷气体的流量。
(4)设甲烷和乙烷的物质的量分别是x、y,则丙烯和乙烯也分别是x、y。根据题意可知烯烃的质量是0.7g,氧化铜减少的质量是氧原子的质量,即和烷烃结合的氧原子是0.11mol,所以42x+28y=0.7、4x+7y=0.11,解得x︰y=1︰1。
(5)亚硫酸钠能把剩余的溴水还原,方程式为SO32-+Br2+H2O=SO42-+2Br-+2H+。由于卤代烃不溶于水,所以分液即可。两种卤代烃互溶,但沸点差别大,蒸馏即可。
本题难度:一般
5、实验题 (14分)某同学用图示装置进行铁和稀硝酸反应的实验并进行相关的实验探究。

a.向广口瓶内注入足量热NaOH溶液,将盛有一定质量的纯铁粉的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸人瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中缓慢滴入一定量的4mol·L-1的稀硝酸,
铁粉完全溶解。
(一)气体产物成分探究
(1)实验前如何检查该装置的气密性????????????????????????????????????。
(2)燃烧红磷的目的是??????????????。
(3)为证明气体产物为NO,步骤c后还缺少的一步主要操作是???????????。
(二)产物中铁元素价态探究:
(1)提出合理假设:
假设1:产物中只有+2价铁;假设2:?????????????,假设3:产物中既有+2价铁,又有+3价铁。
(2)设计实验方案,验证假设1成立(写出实验操作步骤、现象和结论):????????????????????。
(三)问题讨论
(1)广口瓶中热NaOH溶液的主要作用是??????????????。
(2)若假设3成立,且所得溶液中n(Fe2+):n(Fe3+)=3:1时,则对应的离子反应方程式为??????。
参考答案:(一)(1)关闭止水夹,通过分液漏斗向广口瓶中加水,当水不能
本题解析:
试题分析:(一)(1)实验前检查该装置的气密性的方法是关闭止水夹,通过分液漏斗向广口瓶中加水,当水不能顺利滴下时停止加水。观察分液漏斗中水面,若水面不下降,说明装置气密性良好;(2)燃烧红磷的目的是除去广口瓶内空气中的氧气,避免干扰铁和稀硝酸反应产生的气体检验;(3)为证明气体产物为NO,步骤c后还缺少的一步主要操作是打开止水夹,向瓶内迁入少量空气(或氧气),看气体是否变为红棕色,若变为红棕色,就证明产生了NO,否则没有。(二)(1)假设1:产物中只有+2价铁;假设2:产物中只有+3价铁;假设3:产物中既有+2价铁,又有+3价铁。(2)证明只有+2价铁的实验方案是取小烧杯中反应后溶液少许,放入一只试管中,滴加KSCN溶液。溶液不显红色,再向其中滴加少量的H2O2溶液,溶液显红色。则证明假设1成立。?(三)问题讨论(1)广口瓶中热NaOH溶液的主要作用是将实验结束后,在充入足量空气(或氧气)的条件下,将瓶中氮的氧化物完全吸收,以防止空气污染;(2)若产物中既有+2价铁,又有+3价铁,且所得溶液中n(Fe2+):n(Fe3+)=3:1时,根据电子守恒可得相应的离子反应方程式为4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+5H2O。
本题难度:一般
|
|