微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
A.在空气中敞口久置的浓硫酸,溶液质量增大(脱水性)
B.在加热条件下铜与浓硫酸反应(氧化性、酸性)
C.蔗糖与浓硫酸反应中有海绵状的炭生成(吸水性)
D.浓硫酸可用来干燥某些气体(不挥发性)
参考答案:B
本题解析:浓硫酸具有吸水性,所以敞口放置,溶液质量会增加。在浓硫酸和铜的反应中,有硫酸铜、SO2和水生成,所以在反应中浓硫酸表现出氧化性和酸性。C属于浓硫酸的脱水性,D属于浓硫酸的吸水性。所以正确的答案是B。
本题难度:简单
2、填空题 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。
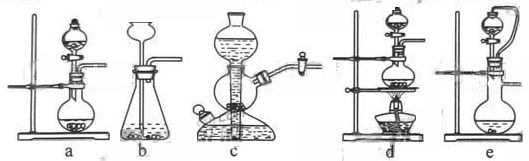
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是?????????(填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠??????g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠???????g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
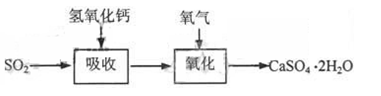
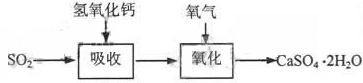
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:

已知:
试剂
| Ca(OH)2
| NaOH
|
价格(元/kg)
| 0.36
| 2.9
|
吸收SO2的成本(元/mol)
| 0.027
| 0.232
?
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是?????????????????。和碱法相比,石灰-石膏法的优点是?????????????,缺点是????????????????。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
参考答案:
 本题解析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的; 本题解析:(1)用硫酸和亚硫酸钠制取SO2的试剂为固态和液态,反应条件不需加热,可通过控制添加硫酸的速率来控制反应速率,结合装置可知a、e可达到目的;
(2)???? H2SO4+Na2SO3=Na2SO4+SO2+H2O
126g???????? 22.4L
m?????????? 3.36L
m=18.9g
4g亚硫酸钠被氧化为硫酸钠后的质量变为4.5g,则有4.0%亚硫酸钠被氧化为硫酸钠的样品中,亚硫酸钠的质量分数为95.5%,因此称取样品的质量为19.8g。
(3)石
本题难度:一般
3、实验题 标准状况下,将1L可能含有N2,H2,CO,NH3,NO2,H2S杂质的无色SO2气体,依次通过如下图所示的装置。(各容器中液体均为足量)

其变化情况是:①气体通过A瓶,浓H2SO4无明显变化,气体体积无变化;②气体通过B瓶,饱和Na2CO3溶液质量增加0.5g,气体体积无变化;③气体通过C瓶后,再通过D管,灼热的CuO中有红色物质生成。冷却后,气体体积变为888ml(标准状况);④将上述气体通过E后,再通入F中,澄清石灰水变浑浊,同时增重1.54g;⑤气体经过干燥管P后,在量筒H中,收集到水104ml。根据以上实验回答:
(1)混合气体中SO2的体积分数为______________。
(2)混合气体中含有的杂质为______________。
(3)混合气体中是否含有H2、CO杂质;若有,指出其体积;若无,说明理由。
a.H2:____________________________________________________________________;
b.CO: ____________________________________________________________________。
参考答案:(1)56%;(2)N2,H2,CO;(3)H2∶112mL
本题解析:①气体通过浓H2SO4,体积无变化,说明无NH3和H2S(H2S与浓H2SO4发生氧化还原反应)。
②气体通过饱和Na2CO3溶液质量增加0.5g,发生了反应:
SO2+Na2CO3=Na2SO3+CO2 Δm
22.4L ∶ 44g (64-44)g
V(SO2) ∶ m(CO2) 0.5g
V(SO2)=0.56L??? m(CO2)=1.1g
φ(SO2)=0.56L/1L×100%=56%
③通过灼热的CuO有红色物质生成,说
本题难度:简单
4、填空题 下图是各物质的反应关系图:已知A和E都是黄色粉末。F有刺激性气味且有漂白性常被不法商人用来漂白腐竹等。请据此回答下列问题:
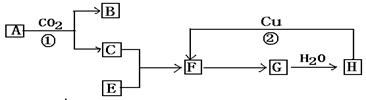
(1)写出下列各物质的化学式:A.__________???? H.___________;
(2)写出反应①和反应②的化学方程式:
①___________________________________________________;
②__________________________________________________。
参考答案:(共12分)
(1)Na2O2; H2 SO4
本题解析:
试题分析:(1)、由题意可知,具有刺激性气味,有漂白性的F为SO2;由转化关系及主要物质的性质可知,A、B、C、E、F、G、H分别为Na2O2、Na2CO3、O2、S、SO2、SO3、H2SO4;(2)、过氧化钠常用作供氧剂,与CO2发生氧化还原反应,生成碳酸钠和氧气,反应式为2Na2O2+2CO2=2Na2CO3+O2;铜与浓硫酸混合加热,反应生成硫酸铜、二氧化硫和水,反应式为Cu+2H2SO4(浓) 本题难度:一般 本题难度:一般
5、选择题 化学与生产生活、环境密切相关,下列说法正确的是
A.为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏
B.玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料
C.将废电池深埋,可以避免重金属污染
D.弱酸性或中性条件下,钢铁腐蚀的正极反应式为:4OH--4e-=O2+2H2O
参考答案:B
本题解析:分析:A.根据蛋白质变性的条件是:受热、高能射线,紫外线、强酸、强碱、重金属盐、某些有机物;
B.根据传统无机非金属材料的工业制备需要的原料和反应原理分析;
C.电池中的重金属离子会带来污染;
D.中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应;
解答:A.高温能使蛋白质变性,所以疫苗等生物制剂应冷冻保藏,故A错误;
B.制水泥、玻璃、陶瓷都是传统无机非金属材料,主要是硅酸盐产品,制备原料都需要用到含硅元素的物质,故B正确;
C.电池中的重金属离子会带来污染,所以废电池要集中处理,故C错误;
D.中性或弱酸性条件下,钢铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故D错误;
故选:B.
点评:本题考查化学与生活,明确物质的性质是解本题关键,利用化学知识解释生活现象,学以致用.
本题难度:简单
|