微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质不能通过化合反应制得的是( ? )
A.Fe(OH)2
B.Fe(OH)3
C.Al2O3
D.FeCl2
参考答案:A
本题解析:
本题难度:简单
2、填空题 (15分)铁和铁的化合物在工业生产和日常生活中都有广泛的用途,请回答下列问题:
(1)铁元素在周期表中的位置是????????????。
(2)写出Fe与稀硫酸反应的离子方程式????????????。
(3)已知:Fe2O3(s)+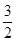 C(s)=
C(s)=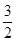 CO2(g)+2Fe(s);△H=+234.1kJ/mol
CO2(g)+2Fe(s);△H=+234.1kJ/mol
C(s)+O2(g)=CO2(g); △H=-393.5kJ/mol.
请写出Fe(s)与O2(g)反应生成Fe2O3(s)的热化学方程式???????????。
(4)在一定条件下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为???????????mol/(L·h).
2Fe(s)+3CO2(g);工业上有16 t Fe2O3在200m3的容器中反应,l小时后测得Fe2O3的转化率为50%,则这段时间内CO的消耗速率为???????????mol/(L·h).
(5)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸钠( Na2FeO4)是一种新型饮水消毒剂.用题29图装置可以制取少量高铁酸钠.
①此装置中爱迪生蓄电池的负极是____(填“a”或"b”).
②写出阳极的电极反应式________.
③当制得132.8g高铁酸钠时,阳极区减少的阴离子的物质的量为????????????.
参考答案:(1)第四周期,Ⅷ族(2分)
(2)Fe+2H+= F
本题解析:(1)铁的原子序数是26,位于第四周期,Ⅷ族。
(2)铁和稀硫酸反应生成硫酸亚铁和氢气,方程式为Fe+2H+= Fe2++H2↑。
(3)考查盖斯定律的应用。根据已知反应可知②×2/3-①即得到2Fe(s)+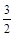 O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1
O2(g) = Fe2O3(s) ,所以反应热是-393.5kJ/mol×3/2-234.1
本题难度:一般
3、计算题 用黄铜矿炼铜按反应物和生成物可将总反应可以写成:
CuFeS2 + SiO2 + O2→ Cu + FeSiO3 + SO2
事实上冶炼反应是分步进行的。(1)黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;(2)硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;(3)硫化亚铜与氧气反应生成氧化亚铜;(4)硫化亚铜与氧化亚铜反应生成铜。
1)??写出上述各个分步反应(1,2,3,4)的化学方程式。
2)??给出总反应方程式的系数。
3)??据最新报道, 有一种叫Thibacillus ferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐。反应是在酸性溶液中发生的。试写出配平的化学方程式。
4)??最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2 (空气)反应, 生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,成本降低了许多。实验结果如下:
沸腾炉温度/℃
| 560
| 580
| 600
| 620
| 640
| 660
|
生
成
物
| 水溶性Cu/%
| 90.12
| 91.24
| 93.50
| 92.38
| 89.96
| 84.23
|
酸溶性Cu/%
| 92.00
| 93.60
| 97.08
| 97.82
| 98.16
| 98.19
|
酸溶性Fe/%
| 8.56
| 6.72
| 3.46
| 2.78
| 2.37
| 2.28
回答如下问题:
(1) ?CuFeS2和O2主要反应的方程式为:
(2) ?实际生产过程的沸腾炉温度为 600~620℃。控制反应温度的方法是:
(3) ?温度高于600~620℃生成物中水溶性Cu (%)下降的原因是:
参考答案:(1)2CuFeS2 + O2 =Cu2S + 2FeS +
本题解析:本题由三个相互独立的问题组成,可以认为是三个题,占总分的较大比例,但由于都是有关黄铜矿的利用问题,因而被编在一起,而且多少相互之间可以起到“条件不同反应不同”的关联作用。与前两题相比,本题的第一部分比较简单,好像是命题人考虑着对前面的试题可能解答得不好的学生起一点安抚鼓励作用。写四个分步反应的方程式的考核点只是把题面的表述转换成化学方程式,但题面并没有指出生成物中的硫的形态。根据中学化学知识,可以想见它是SO2,大多数学生应该不会写错。其中第四个反应就是所谓“冰铜”反应,比较特殊,但试题已经告诉大家反应产
本题难度:一般
4、填空题 铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
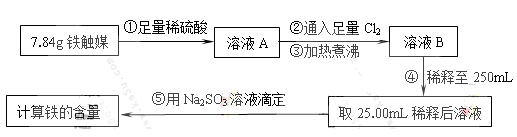
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸????????mL
(2)步骤②通入Cl2的目的是?????????????????(用离子方程式表示)
(3)步骤④后需用???????????(填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为?????????????。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式?????????????????????,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的????????????作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
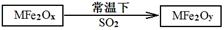
则可以判断x???????y,氧化性:MFe2Oy???????SO2(填“>”、“<”或“=”)
参考答案:Ⅰ.(1)8.2(2)2Fe2++Cl2=2Fe3++2Cl
本题解析:
试题分析:Ⅰ.在溶液稀释前后溶质的物质的量不变,利用稀释公式C1V1=C1V2可得1.50 mol·L-1×100m=18.4mol·L-1×Vml,解得V="8.2ml." (2)步骤②通入Cl2的目的是把亚铁离子氧化为铁离子,离子方程式是2Fe2++Cl2=2Fe3++2Cl-(3)氯化铁溶液显酸性要用移液管或酸式滴定管来量取,防止腐蚀碱式滴定管的橡胶管。(4)2Fe3++SO32-+H2O=2Fe2+SO42-+2H+可利用铁离子与亚硫酸根离子的关系求解得到原来的固体中含有铁的总物质的量为0
本题难度:一般
5、实验题 (12分)某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有????????(填仪器名称);操作II必须用到的仪器是????????????。(填字母)
A.50ml烧杯
B.50ml量筒
C.100ml量筒
D.25ml滴定管
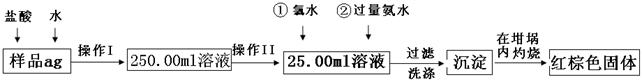
⑵再加入氨水的离子方程式为???????????????????????????????。
⑶检验沉淀是否洗涤干净的操作是
????????????????????????????????????????????????????????????????。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,则接下来还应进行的操作是?????????????。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是????????????????????。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干燃烧称量即可,请你评价是否可行?????????。(填“可行”或“不可行”)
参考答案:⑴250ml容量瓶(1分) D(1分)⑵Fe3++3NH3H
本题解析:(1)根据配制原理可知,还缺少250ml容量瓶。操作II是准确量取溶液的,所以应该用滴定管,答案选D。
(2)加入氨水的目的是沉淀溶液中的铁离子,方程式是Fe3++3NH3H2O = Fe(OH)3↓+3NH4+。
(3)沉淀表面吸附着氯离子,所以可以通过检验氯离子的方法检验沉淀是否洗净,即取少量最后一次洗液于试管中,加入AgNO3溶液,若无白色沉淀,则沉淀洗净。
(4)b1—b2=0.3,说明固体还需要再次加热,即继续加热,冷却至室温时,称量,直至两次连续称量质量差不超过0.1g为止。
本题难度:一般
|