微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (普通班)(15分)已知常温下,AgBr的Ksp=4.9×10-13,AgI的Ksp=8.3×10-17.
(1)AgBr固体在水中达到溶解平衡,写出其表达式 ;此时溶液中c(Ag+)= mol/L;
(2)现向AgBr的悬浊液中:①加入AgNO3固体,则c(Br -) (填“变大”、“变小”或“不变”,下同);②若改加更多的AgBr固体,则c(Ag+) ;
③若改加更多的KI固体,则c(Ag+) ,c(Br -) 。
(3)有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是( )
A.将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积
B.两种难溶盐电解质,其中Ksp小的溶解度也一定小
C.难溶盐电解质的Ksp与温度有关
D.向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变
2、选择题 氯化银在水中存在AgCl(s) 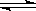 ?Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
?Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
A.①②③④
B.③④①②
C.①②④③
D.③④②①
3、选择题 下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.反应Hg(1)+H2SO4(aq) = HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0
C.将纯水加热至较高温度,K变大、pH变小、呈酸性
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
4、选择题 下列现象或反应的原理解释不正确的是?[???? ]
现象或反应
原理解释
A.
水在高温下难分解
水分子之间存在氢键
B.
铝箔在酒精灯火焰上加热熔化但不滴落
Al2O3熔点高于Al单质
C.
将氯化银溶于水,向其中加入KI生成黄色沉淀
Ksp(AgI)<Ksp(AgCl)
D.
2CO=2C+O2在任何条件下均不能自发进行
该反应?△H>0,?△S<0
5、填空题 亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-?被氧化为I2时,产物中含氮的物质为_________(填化学式)。
(2)要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_____(填序号)。
a.?稀硫酸 ?b.?二氧化碳 ? ?c.?二氧化硫 ??d.?磷酸
(3)工业废水中的NO2-?可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、
NaOH、NH3、H2O六种物质。将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中:
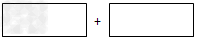
上述反应后废水的pH值将_______(填“上升”、“下降”或“不变”)。
(4)若改用电解法将废水中NO2-?转换为N2除去,N2将在_____(填电极名称)生成
(5)若工业废水中的NO2-的浓度约为1.0×10-4mol/L,取工业废水5mL于试管中,滴加2滴0.1mol/L的硝酸银溶液,能否看到沉淀?(通过计算说明)。(已知Ksp(AgNO2)=2×10-8?mol2·Lˉ2)