微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 电解原理在化学工业生产中有广泛的应用.如图为电解氯化铜溶液的电解池,X、Y为惰性电极板.下列有关说法正确的是( )
A.X为负极,Y为正极
B.Y极表面变红,质量增加
C.阳极发生氧化反应:2Cl--2e-═Cl2↑
D.电解时,溶液中电子的流向是:X→Y

参考答案:A、装置图分析与电源正极相连的Y电极为阳极,与电源负极连接的
本题解析:
本题难度:一般
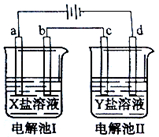
2、选择题 下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是
选项
| X
| Y
|
A.
| MgSO4
| CuSO4
|
B.
| AgNO3
| Pb(NO3)2
|
C.
| FeSO4
| Al2 (SO4)3
|
D.
| CuSO4
| AgNO3
参考答案:D
本题解析:
试题分析:电解过程中,Pt电极为惰性电极,电极b和d均为阴极,电极上没有气体逸出,但质量均增大,说明金属阳离子放电析出,要使增重b<d,即d析出金属的离子Mr/带电荷较大。A中X溶液Mg2+不放电;Mr(Ag+)/1=108,Mr(Pb2+)/2=103.6,后者小,不正确。C中Al3+在溶液中不放电;D中Mr(Cu2+)/2=32,Mr(Ag+)/1=108,满足题意。
本题难度:简单
3、填空题 如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极,请回答下列问题:
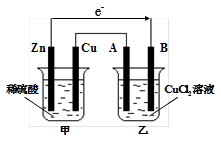
(1)Zn电极为 极,B电极上的产物是 (写化学式)
(2)写出乙装置中发生反应的化学方程式
参考答案:(1)负 Cu (2)CuCl2![]()
本题解析:
试题分析:(1)锌比铜活泼,且锌能和稀硫酸反应,所以甲装置是原电池,乙装置是电解池。其中锌是负极,B电极是阴极,溶液中的铜离子在阴极放电,生成单质铜。
(2)惰性电极电解氯化铜溶液的方程式是CuCl2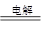 Cu+Cl2↑。 Cu+Cl2↑。
考点:考查原电池、电解池的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查。试题紧扣教材,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
4、填空题 下图是氯碱工业中离子交换膜电解槽示意图,其中离子交换膜为“阳离子交换膜”,它有一特殊的性 质--只允许阳离子通过,而阻止阴离子和气体通过。

(1)电解后得到的氢氧化钠溶液从____口流出(填字母代号),b口排出的是____气体,电极1应连接电源的___极(填“正”或“负”);理论上讲,从f口加入纯水即可,但实际生产中,纯水中要加入一定量的NaOH溶液,其原因是____。
(2)下图是根据氯碱工业中离子交换膜技术原理,设计的电解Na2SO4溶液生产NaOH和H2SO4溶液的装置。请回答:
①a为____(填“阳”或“阴”)离子交换膜;
②阳极电极反应式是___ ,
③从D、E口流出或流进的物质的化学式(若为溶液,则写出溶质的化学式)____、____。

参考答案:(1)d; Cl2 ;正; 增强溶液的导电性,又不影响NaO
本题解析:
本题难度:一般
5、填空题 (10分)(1)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏(CaSO4·2H2O)可以降低土壤的碱性。试用化学方程式表示用石膏降低土壤碱性的反应原理________。
(2)习惯上把电解饱和食盐水的工业生产叫做氯碱工业,用化学方程式表示电解饱和食盐水的总反应为________________________。
(3)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是_____________。(填写化学式,只填一种即可)
(4)通过火法冶金炼出的铜是粗铜,不适于电器及其他许多工业使用,必须进行电解精炼。电解时,用________作阴极,________作阳极。
参考答案:(1)Na2CO3 + CaSO4=CaCO3 + Na2S
本题解析:
试题分析:(1)土壤的碱性主要是Na2CO3水解引起的,加入适量的石膏发生:Na2CO3 + CaSO4 =CaCO3 + Na2SO4,减少了CO32-,可以可以减低碱性。(2)电解饱和食盐水的总反应为2NaCl + 2H2O 2NaOH+Cl2↑+H2↑(3)为了除去MgCl2酸性溶液中的Fe3+,向溶液中加入试剂使Fe3+转化为沉淀而除去,为不引入新的杂质,应该加入MgO或Mg(OH)2。(4)铜的精炼是要用纯铜作阴极,粗铜做阳极,通电时纯铜不放电,粗铜在阳极放电,生成铜离子。 2NaOH+Cl2↑+H2↑(3)为了除去MgCl2酸性溶液中的Fe3+,向溶液中加入试剂使Fe3+转化为沉淀而除去,为不引入新的杂质,应该加入MgO或Mg(OH)2。(4)铜的精炼是要用纯铜作阴极,粗铜做阳极,通电时纯铜不放电,粗铜在阳极放电,生成铜离子。
考点:沉淀的转化,电解中氯碱工业、金属的冶炼的基本知识。
本题难度:一般
|