微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知相同条件下同浓度的NaCN与NaF的稀溶液,前者的pH值大于后者,相同条件下比较同浓度同体积两种溶液中的关系,其中正确的是
A.c(CN-)>c(F-)
B.c(Na+)=c(CN-)=c(F-)
C.NaCN水解程度比NaF大
D.两者所含水分子总数相等
参考答案:C
本题解析:
试题分析:NaCN的pH值大于NaF,CN-水解程度大于F-,所以c(CN-)<c(F-),故A错误;c(Na+)> c(F-)> c(CN-),故B错误; NaCN水解程度比NaF大,故C正确;两者所含水分子总数不相等,故D错误。
考点:本题考查盐的水解。
本题难度:一般
2、实验题 (1)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。
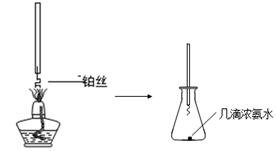

图a 图b
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
(2)三价铁盐溶液因Fe3+水解而显棕黄色,请以Fe(NO3)3溶液为例,设计实验探究影响盐类水解程度的因素。
①写出Fe(NO3)3水解的离子方程式 。
②参照示例完成下表实验方案的设计。
限选材料:0.05mol?L-1Fe(NO3)3、0.5mol?L-1Fe(NO3)3、1.0mol?L-1HNO3、1.0mol?L-1NaOH、NaHCO3固体、蒸馏水、冰水混合物;pH计及其他常见仪器。
可能影响因素
| 实验操作
| 预期现象和结论
|
溶液的酸碱性
| 取少量0.5mol?L-1Fe(NO3)3于试管中,加入几滴1mol?L-1HNO3。
| 棕黄色溶液颜色变浅,说明溶液酸性增强能抑制Fe(NO3)3的水解。
|
盐的浓度
|
|
|
|
|
参考答案:(1)(共4分)① NH4NO3 &#
本题解析:
试题分析:(1)①氨与氧气发生催化氧化,生成NO和水,NO与空气中的氧气反应生成红棕色气体二氧化氮,二氧化氮与水反应又有硝酸生成,硝酸与氨气反应生成白色固体硝酸铵,则白烟的成分是NH4NO3;
②二氧化氮溶于水,生成硝酸和无色气体NO,同时瓶内压强减小,所以看到集气瓶内红棕色气体消失,集气瓶中的液面逐渐上升;
(2)①Fe(NO3)3水解生成氢氧化铁和硝酸,离子方程式为Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+
②影响盐水解程度的因素有浓度、温度。根据铁离子水解的离子方程式判断增大铁离子浓度平衡正向移动,可采用不同浓度的Fe(NO3)3溶液,进行实验,测定溶液的pH,判断水解程度的大小;增大H+ 浓度平衡逆向移动,溶液棕黄色变浅;水解反应可看成是中和反应的逆反应,所以是吸热反应,升高温度平衡,正向移动,溶液棕黄色加深。具体实验如下表:
影响条件
实验操作
预期现象和结论
②盐的浓度
用量筒取10mL Fe(NO3)3于烧杯中,用pH计测出pH值.另取90mL蒸馏水加入烧杯,充分搅拌,再用pH计测出pH值。
前后测得pH值之差小于1。说明加水稀释后平衡右移,生成更多的H+,故增大Fe(NO3)3浓度,抑制Fe(NO3)3水解。
或②盐的浓度
用pH计分别测定0.05mol?L-1Fe(NO3)3和0.5mol?L-1Fe(NO3)3的pH,并比较大小。
二种溶液的pH值之差小于1。说明增大c(Fe(NO3)3),抑制Fe(NO3)3水解。
或②盐的浓度
取少量0.5mol?L-1Fe(NO3)3于试管中加入少量NaHCO3固体。
溶液颜色变深。说明加入少量NaHCO3固体可减少c(H+)促进Fe(NO3)3水解。
或②盐的浓度
取少量0.5mol?L-1Fe(NO3)3于试管中加入几滴1.0mol?L-1NaOH
产生红棕色沉淀,棕黄色溶液变成无色,说明加入NaOH可减少c(H+)能促进Fe(NO3)3水解。
③升高温度
取少量0.5mol?L-1Fe(NO3)3于试管中,再用酒精灯加热一段时间,观察溶液颜色
加热后溶液颜色变深。说明升高温度促进Fe(NO3)3水解。
或③降低温度
取少量0.5mol?L-1Fe(NO3)3于试管中,再将试管置于放有冰水混合物的烧杯中一段时间,观察溶液颜色
棕黄色溶液颜色变浅。说明降低温度能抑制Fe(NO3)3水解。
考点:考查氨气的催化氧化、二氧化氮的吸收,铁离子的水解及影响水解程度的条件的实验设计
本题难度:困难
3、选择题 向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42-)时,溶液的pH ( )
A.等于7
B.大于7
C.小于7
D.无法判断
参考答案:A
本题解析:根据电荷守恒可知,2c(SO42-)+c(OH-)=c(NH4+)+c(H+)。所以如果溶液中c(NH4+)=2c(SO42-)时,c(OH-)=c(H+),即溶液显中性,答案选A。
本题难度:一般
4、选择题 在一定条件下发生下列反应,其中属于盐类水解反应的是( ? ) A.NH4++2H2O?NH3?H2O+H3O+
B.HCO3-+H2O?H3O++CO32-
C.HS-+H+═H2S
D.Cl2+H2O?H++Cl-+HClO
参考答案:A
本题解析:
本题难度:简单
5、选择题 为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入适量( )①浓盐酸 ②NaCl固体 ③浓氨水 ④NaOH固体
A.③
B.④
C.①②
D.③④
参考答案:A
本题解析:NH4Cl溶液中NH4+要发生水解,使溶液呈酸性,在溶液中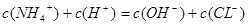 ,若NH4+的浓度与Cl-的浓度比为1:1,则溶液中 ,若NH4+的浓度与Cl-的浓度比为1:1,则溶液中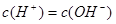 ,为中性溶液,为不引入其他杂质离子,应加入浓氨水,所以正确选项为A。 ,为中性溶液,为不引入其他杂质离子,应加入浓氨水,所以正确选项为A。
本题难度:一般
|