pH=10
请回答下列问题:
(1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸 。
(2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1 ?(填“是”或“否”)。混合溶液中c(A-)与 c(Na+)离子浓度的大小关系是 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断 c(Na+)离子浓度的大小关系是 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断
(3)从丙组结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
参考答案:
 本题解析:略 本题解析:略
本题难度:困难
2、填空题 (10分)(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. Cl2水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
参考答案:(1)B CD (2)4
本题解析:(1)B;过氧化氢为绿色氧化剂被还原后生成水,不引入新的杂质;
除杂质的同时不能引入新的杂质,正确选项为C、D;
(2)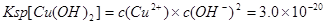 则 则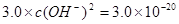 , ,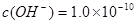 ,即POH=10,PH=4; ,即POH=10,PH=4;
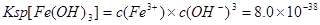 ,则 ,则
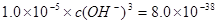 ,即可得PH=3.3;该方案可行; ,即可得PH=3.3;该方案可行;
本题难度:困难
3、选择题 在0.1mol·L-1 的Na2CO3溶液中,下列关系正确的是
A.c(Na+)=2c(CO32-)
B.c(HCO3-)>c(H2CO3)
C.c(Na+)<[c(CO32-)+c(HCO3-)]
D.c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
参考答案:B
本题解析:碳酸钠是强碱弱酸盐,CO32-水解显碱性,因此c(Na+)>2c(CO32-) ,A不正确。由于CO32-的第一步水解大于第二步水解,所以选项B正确。C不正确,不符合物料守恒,应该是c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]。D不正确,不符合质子守恒,应该是c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),答案选B。
本题难度:困难
4、选择题 在蒸发皿中加热蒸干下列物质的水溶液并灼烧(低于400℃),可以得到该物质的固体的是
A.氯化铝
B.碳酸氢钠
C.硫酸镁
D.高锰酸钾
参考答案:C
本题解析:
试题分析:
A、AlCl3因为能水解生成Al(OH)3和HCl,加热HCl挥发,水解彻底进行,生成Al(OH)3沉淀,灼烧Al(OH)3得Al2O3,故A不合题意;
B、NaHCO3在加热条件下易分解生成碳酸钠、二氧化碳和水,故B不合题意;
C、硫酸镁虽然能够水解,但是因为生成的酸是硫酸,为难挥发性酸,不能使水解彻底,可以得到原物质,故C符合题意;
D.KMnO4受热易分解锰酸钾、二氧化锰与氧气,故D不合题意。
考点:盐类的水解及其影响因素
点评:本题考查了盐类的水解及其影响因素,难度不大。本题易错点是在A、C的区别上,虽然同为易水解的盐类,但是因为二者生成的酸的挥发性的不同,导致二者蒸干后的产物不同。
本题难度:一般
5、选择题 下列关系的表述中,正确的是
A.0.1mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
参考答案:C
本题解析:
答案:C
A.不正确,0.1mol·L-1NaHCO3溶液中,电荷守恒:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32
本题难度:一般
|