微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:2.7 g AlX溶液Al(OH)3沉淀
方案②:2.7 g AlY溶液Al(OH)3沉淀
NaOH和HCl的浓度均是3 mol/L,如图是向X溶液和 Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
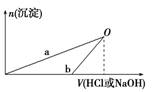
A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2
B.b曲线表示的是向X溶液中加入NaOH溶液
C.在O点时两方案中所得溶液浓度相等
D.a、b曲线表示的反应都是氧化还原反应
参考答案:C
本题解析:略
本题难度:一般
2、选择题 等体积等物质的量浓度的下列溶液与足量的铝充分反应,相同条件下,放出氢气的体积最大的是
A.氢氧化钠溶液
B.稀硫酸
C.盐酸
D.稀硝酸
参考答案:A
本题解析:
试题分析:稀硝酸与Al反应不放出氢气。排除。2Al+2H2O+2NaOH=2NaAlO2+3H2↑. 2Al+3H2SO4= Al2(SO4)3 +3H2↑.2Al+6HCl=AlCl3+3H2↑。如果这几种物质的量相同,则NaOH溶液放出的氢气体积最大。故选项为A。
本题难度:一般
3、填空题 工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下:
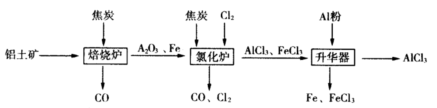
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移______mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为?????????。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②将AlCl3· 6H2O溶于浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的???????(填字母序号)。
①氧化性? ②吸水性? ③难挥发性? ④脱水性
a.只有①??? b.只有②??? c.只有②③??? d.只有②③④
(3)海洋灯塔电池是利用铝、石墨为电极材料,海水为电解质溶液,构成电池的其正极反应式________,与铅蓄电池相比.释放相同电量时,所消耗金属电极材料的质量比m(Al): m(Pb)=__________________。
参考答案:(1)-467.5
(2)①3?? Cl2+SO32-
本题解析:(1)由①+②得所求方程式,所以△H=-467.5kJ·mol
(2)① 由2Al2O3+3Cl2+3C=2AlCl3+3CO知,生成2molAlCl3转移电子数为6,则1mol AlCl3时转移3mol电子;根据题意得:Cl2+SO32-+H2O=2Cl-+SO42-+2H+;Al+FeCl3=Fe+AlCl3由于AlCl3升华而FeCl3不升华,温度在应315℃以下。
②此处只用到吸水性,难挥发性。
(3)氧气在中性溶液中正极反应:O2+4e-+2H2O=4OH-;设都放出6mole
本题难度:一般
4、选择题 下列有关金属铝及其化合物的叙述正确的是
[???? ]
A.铝在常温下不能与氧气反应
B.铝不能与氯气反应
C.铝既能溶于酸,又能溶于碱
D.氧化铝只能与酸反应,不能与碱反应
参考答案:C
本题解析:
本题难度:简单
5、选择题 将5.1gMgAl合金溶解在过量的500mL2mol/L的盐酸中,然后加入4mol/LNaOH溶液。若要使生成的沉淀最多,则应加入的这种NaOH溶液的体积是
A.200mL
B.250 mL
C.425mL
D.560mL
参考答案:B
本题解析:在整个过程中相当于盐酸和氢氧化钠反应,故有0.5L×2mol/L=V×4mol/L,V=250ml。
本题难度:一般