微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 wg铁粉和铝粉的混合物,和过量的?NaOH反应,然后过滤,将沉淀完全收集后,放蒸发皿中加热,直至被加热的物质质量不再变化,取出蒸发皿中的物质称量仍为wg.求原混合物中铝粉的质量分数是( )
A.30%
B.50%
C.70%
D.90%
参考答案:wg铁粉和铝粉的混合物,和过量的NaOH反应,然后过滤,滤渣
本题解析:
本题难度:简单
2、选择题 下列关于铁、铝氧化物的说法中,正确的是(??? )
A.铁、铝氧化物均只有一种
B.铁、铝氧化物均可与盐酸反应
C.铁、铝氧化物均不能与碱反应
D.铁、铝氧化物均可以被还原
参考答案:BD
本题解析:铁的氧化物有FeO、Fe2O3、Fe3O4等三种,A项错误。上述铁的氧化物和Al2O3均可与盐酸反应,B项正确。Al2O3可与NaOH反应,C项错误。铁、铝氧化物一定条件均可被还原为铁、铝单质,D项正确。
本题难度:简单
3、填空题 (6分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
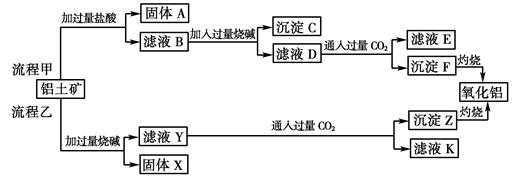
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为??????????????????????????。
(2)流程乙加入烧碱后生成SiO32—的离子方程式为????????????????????????????。
(3)验证滤液B含Fe3+,可取少量滤液并加入?????????????(填试剂名称)。
(4)滤液E、K中溶质的主要成份是??????????(填化学式),写出该溶液的一种用途
???????????????。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=????????。
参考答案:(6分,每空1分):(1)Al2O3+6H+===2Al3+
本题解析:(1)氧化铝是两性氧化物,和盐酸反应的方程式是Al2O3+6H+===2Al3++3H2O。
(2)二氧化硅是酸性氧化物,和氢氧化钠溶液反应的方程式是SiO2+2OH-===SiO+H2O。
(3)检验铁离子的试剂是KSCN溶液或者是苯酚。
(4)由于CO2都是过量的,所以溶液中的溶质主要都是碳酸氢钠,其主要用途是制纯碱或做发酵粉等。
(5)pH=13,所以溶液中的OH-浓度是0.1mol/L,因此根据氢氧化镁的溶度积常数可知,此温度下残留在溶液中的c(Mg2+)=5
本题难度:一般
4、选择题 在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断不正确的是(? )
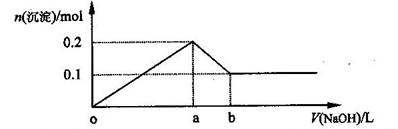
A.NaOH的浓度为0.6 mol/L
B.在a点处溶液中的溶质为NaCl
C.在b点处溶液中的溶质只有NaAlO2
D.图中线段oa : ab=5 : 1
参考答案:C
本题解析:由沉淀的量可知原溶液中AlCl3和MgCl2的物质的量均为0.1 mol,在a点两金属离子恰好全部沉淀,耗NaOH0.5mol,b点处氢氧化铝全部溶解,耗NaOH0.1mol,溶液中的溶质除NaCl外还有NaAlO2
本题难度:一般
5、选择题 下图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是(????)

A.NH4Al(SO4)2
B.KAl(SO4)2
C.Al2(SO4)3
D.NaAlO2
参考答案:C
本题解析:
试题分析:氢氧化钡从1mol到3mol,沉淀粉的量呈现直线上升,表明成正比例关系,因此只能是硫酸铝了,选C。
本题难度:一般