微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
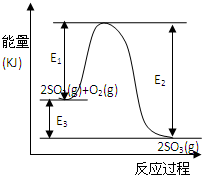
1、填空题 T℃时反应2SO2(g)+O2(g)

2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)写出该反应的热化学方程式(用E1、E2或E3表示,下同)______
(2)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为______,反应______(填“放出”或“吸收”)______热量.(用E1、E2或E3表示)
(3)下列叙述能证明该反应已达化学平衡状态的是______(填序号)
①SO2的体积分数不再发生变化????②容器内压强不再发生变化???③容器内气体原子总数不再发生变化???④相同时间内消耗2n?molSO2的同时生成n?molO2???⑤相同时间内消耗2n?molSO2的同时生成2n?molSO3
(4)在反应体系中加入催化剂,反应速率增大,E1、E2和E3的变化是:E1______,E2______,E3______(填“增大”“减小”或“不变”).
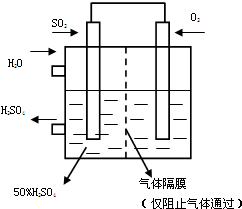
(5)若以右图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:______,______
为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
(6)SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生.写出SOCl2在电池中放电时的电极反应式______.
参考答案:(1)△H=反应物吸收的能量-生成物放出的能量═-E3kJ/
本题解析:
本题难度:一般
2、填空题 (10分)按要求回答下列问题:
(1)已知:
1 mol分子中的化学键断时需要吸收能量/kJ
| H2(g)
| Cl2(g)
| HCl(g)
|
436
| 243
| 431
则:H2(g) + Cl2(g) 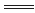 2HCl(g) ΔH= kJ/mol 2HCl(g) ΔH= kJ/mol
(2)已知:乙醇的燃烧热为1411.0 kJ/mol,则乙醇燃烧的热化学方程式可表示为 。
(3)在200℃、101kPa时,H2与碘蒸气作用生成2molHI气体,放出14.9kJ的热量。
热化学方程式可表示为 。
(4)已知:①2CH3OH(l)+3O2(g) 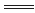 2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ/mol 2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ/mol
②2CO(g)+O2(g)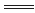 2CO2(g) ΔH2=-566.0 kJ/mol 2CO2(g) ΔH2=-566.0 kJ/mol
③H2O(g)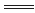 H2O(l)ΔH3=-44.0 kJ/mol H2O(l)ΔH3=-44.0 kJ/mol
上述三个反应中,ΔS<0的是 。甲醇燃烧生成一氧化碳和液态水的热化学方程式是 。
参考答案:(1)-183kJ/mol(2分)
(2)C2H5OH
本题解析:
试题分析:(1)根据化学键键能计算反应热=436+243×2-431=-183kJ/mol(2分)
(2)燃烧热是1摩尔乙醇反应生成二氧化碳和液态水时放出的热量,热化学方程式为:C2H5OH(l)+3O2(g)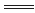 2CO2(g)+3H2O(l)ΔH=-1411kJ/mol。(3)热化学方程式注意系数代表的是物质的量,系数和反应热有对应关系,H2(g)+I2(g) 2CO2(g)+3H2O(l)ΔH=-1411kJ/mol。(3)热化学方程式注意系数代表的是物质的量,系数和反应热有对应关系,H2(g)+I2(g)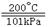 2HI(g)△H=-14.9kJ/mol。(4)ΔS<0代表的是熵变减小的,反应①时熵增的反应,反应②为熵减,反应③时熵减,所以选②③。根据盖斯定律,(反应①-反应②+反应③×4)/2,所以反应=(-1285.6+566-44*4)/2=442.8kJ,热化学方程式为:CH3OH(l)+O2(g) 2HI(g)△H=-14.9kJ/mol。(4)ΔS<0代表的是熵变减小的,反应①时熵增的反应,反应②为熵减,反应③时熵减,所以选②③。根据盖斯定律,(反应①-反应②+反应③×4)/2,所以反应=(-1285.6+566-44*4)/2=442.8kJ,热化学方程式为:CH3OH(l)+O2(g) CO(g)+2H2O(l)ΔH=-442.8kJ/mol。 CO(g)+2H2O(l)ΔH=-442.8kJ/mol。
考点:化学反应进行的方向,热化学方程式的书写。
本题难度:一般
3、填空题 I:能源是人类生活和社会发展的基础,地球上最基本的能源是?,大自然利用这一能源最成功的是?.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ?g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式?.
Ⅱ:理论上任意一个自发的氧化还原反应都能设计成原电池,现有如下反应:
2FeCl3+Cu=2FeCl2+CuCl2
如果将其设计成原电池,请写出负极材料及正极电极反应式.
负极材料:?;正极电极反应式:?.
III:工业上用电解熔融氧化铝的方法制取金属铝.
(1)请写出工业用电解熔融氧化铝制取铝的化学方程式:?.
(2)现冶炼2.7t?铝,需要转移电子的物质的量为?mol.
参考答案:Ⅰ:地球上的能源主要来源于太阳能,通过植物的光合作用被循环利
本题解析:
本题难度:一般
4、选择题 已知热化学方程式:
H2O(g) == H2(g) + O2(g) △H =" +241.8" kJ·mol-1
H2(g)+ O2(g) == H2O(1) △H = -285.8 kJ·mol-1
当1g液态水变为水蒸气时,其热量变化是( )
A.吸热88kJ
B.吸热2.44 kJ
C.放热44kJ
D.吸热44 kJ
参考答案:B
本题解析:根据盖斯定律可知,两式相加即得到H2O(g)=H2O(1),其反应热是241.8 kJ·mol-1-285.8 kJ·mol-1=-44 kJ·mol-1,即18g气态水生成液态水时,会放出44kJ的能量。则1g液态水变为水蒸气时吸收能量是44kJ÷18=2.44 kJ。答案选B。
本题难度:一般
5、选择题 下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1 C(s)+1/2O2(g)===CO(g) ΔH2
②NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH3
NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l) ΔH4
③H2(g)+1/2O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.①
B.②④
C.③④
D.①②③
参考答案:C
本题解析:碳完全燃烧放出的热量多,但放热越多,△H越小,所以①中ΔH前者小于后者;②中都是中和热,△H相等;消耗的氢气越多,放出的热量越多,同样放热越多,△H越小,所以③中ΔH前者大于后者;④中前者是吸热反应,后者是放热反应,ΔH前者大于后者,答案选C。
本题难度:一般
|