微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)室温下,将1.00mol/L盐酸滴入20.00mL 1.00mol/L氨水中,溶液pH和温度(0C)
随加入盐酸体积变化曲线如右图所示。
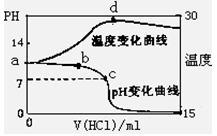
(1)下列有关说法正确的是___________?
A.a点由水电离出的C(H+)=10-14mol/L
B.b点:
C.c点:C(Cl-)=C(NH4+)
D.d点后,容易温度略下降的主要原因是NH3·H2O电离吸热
(2)在滴加过程中,水的电离程度的变化是先? 后??? (填“增大”、“减小”或“不变”);
(3)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和
溶液的pH。试填写表中空白:
?
| 离子浓度的关系
| 溶质
| 溶液的pH
| 物料守恒关系
|
①
| C(NH4+)>C(Cl-)>C(OH-)>C(H+)
| ?
| pH>7
| /
|
②
| ?
| NH4Cl
| /
| ?
|
③
| ?C(Cl-)>C(H+)>C(NH4+)>C(OH-)
| ?
| pH<7
| /
?
2、选择题 盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
A.酒精的燃烧热为Q3 kJ
B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量
3、选择题 313 K时,水的Kw=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液(?? )
A.呈酸性
B.呈中性
C.呈碱性
D.无法判断
4、实验题 (12分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的酸度(酸度单位:g/100ml),现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
|
网站客服QQ: 960335752 - 14613519 - 791315772