微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下表中有九种物质,据表回答: (12分)
| 第I 组
| 第II 组
| 第III 组
|
甲
| BaCl2
| Fe
| Cu(NO3)2
|
乙
| Fe2O3
| K2SO4
| H2SO4
|
丙
| Zn
| Ba(OH)2
| MgCl2
(1) 第III 组中有一种物质能与第 组中的所有物质反应,这种物质是 .
(2) 不跟第I 组中所有物质反应且能与第III 组中所有物质反应的第II 组中的物质是 ,其与硫酸反应的离子方程式为 ;
2、填空题 硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol?L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
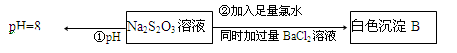
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
3、填空题 (15分)在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛。
(1)溴元素在周期表中的位置为 。
(2)下列说法中正确的是 。
A.CCl4和XeF2分子中各原子最外层均满足8e-结构
B.Cl2O5和Cl2O7都是酸性氧化物
C.氟非金属性强于氯,故氢氟酸的酸性强于盐酸
D.F-、Cl-、Br-、I-等离子的还原性逐渐增强
(3)已知:HCl的沸点是
4、填空题 (12分)(Ⅰ)硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)已知:重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
①BaSO4(s)+4C(s)=BaS(s)+4CO(g) △H=+ 571.2 kJ?mol—1
②BaS(s)=Ba(s)+S(s) △H=+460 kJ?mol—1
已知:③2C(s)+O2(g)=2CO(g) △H=" -221" kJ?mol—1
则:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H= 。
(Ⅱ)污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施就洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3 (aq) ΔH3为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图

则:
①△H3 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应离子方程式为: 。
②电化学降解NO3-的原理如图,阴极反应式为: 。

5、选择题 下列离子方程式正确的是 ( )
A.澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.硫酸铜溶液与氢氧化钡溶液反应:Ba2++SO42
|