微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 原创工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)

CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250°C | 300°C | 350°C
K
2.041
0.270
0.012
①由表中数据判断△H______0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为______,此时的温度为______.
(2)在100℃压强为0.1MPa条件下,容积为V?L某密闭容器中a?mol?CO与?2a?mol?H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的平衡常数K=______(用含a、V的代数式表示并化简至最简单的形式).此时保持温度容积不变,再向容器中充入a?mol?CH3OH(g),平衡______(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数______.(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是______.
A.升温??????????????? B.加入催化剂????????????? C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体????????F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同)______.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
| 容器 | 甲 | 乙 | 丙
| 反应物投入量
1molCO、2moL?H2
1molCH3OH
2molCH3OH
| 平
衡
时
的
数
据
CH3OH浓度(mol/L)
c1
c2
c3
反应的能量变化
akJ
bkJ
ckJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
请选择正确的序号填空(不定项选择)
①c1、c2、c3的关系表达正确的为______
A??c3>2c1??????B?c1<c3<2c1??????C?c1=c2
②a、b、c的关系表达正确的为______
A???c<2|△H|B??a+b=|△H|C??c=2b
③p1、p2、p3的关系不正确的为______
A??p1=p2??????B??p2<p3<2p2???????C??p3>2p2
④a1、a2、a3的关系表达不正确的为______
A??a1=a2???????B?a3<a2??????C??a1+a2=1.
参考答案:(1)①温度升高,K减小,说明升高温度平衡向逆反应方向移动,
本题解析:
本题难度:一般
2、选择题 化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:
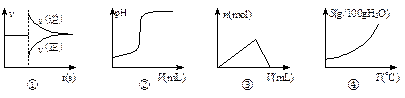
有关上述曲线图的说法正确的是
A.曲线图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.曲线图②可以表示向一定量的盐酸中滴加一定浓度的氢氧化钠溶液时的pH的变化
C.曲线图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时的产生沉淀的物质的量变化
D.曲线图④可以表示所有的固体物质溶解度随温度的变化
参考答案:B
本题解析:略
本题难度:一般
3、填空题 (1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据: 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
t/s
c/(mol·L-1)
| 0
| 20
| 40
| 60
| 80
| 100
| c(N2O4)/(mol·L-1)
| 0.100
| a
| 0.5b
| 0.4b
| ?
| ?
| c(NO2)/(mol·L-1)
| 0
| 0.060
| b
| c1
| c2
| c3
?
请回答下列问题:
①表中a=________,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为________________________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)??H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:____________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是_______________________________。
参考答案:(1)①0.070 1.5×10-3 ②b<c1=c2(或c
本题解析:(1)根据表中数据和反应方程式可得(0.100-a)∶0.060=1∶2,解得a=0.070;由(0.100-0.5b)∶b=1∶2,解得b=0.100;由(0.100-0.4b)∶c1=1∶2,解得c1=0.120,此时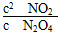 =0.36,即第60 s时反应已达平衡状态。 =0.36,即第60 s时反应已达平衡状态。
(2)①由于情境陌生,在书写化学平衡常
本题难度:一般
4、填空题 汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致: N2(g)+O2(g)?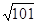 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答: 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
A.消耗1 mol N2同时生成1 mol O2
B.混合气体密度不变
C.混合气体平均相对分子质量不变
D.2v(N2)正=v(NO)逆
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。
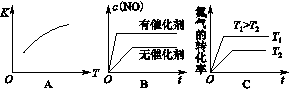
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应___________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是____
参考答案:(1)0.05 mol/(L·min) (2)A、D (3)
本题解析:
试题分析:(1) V(N2)=ΔC(N2)÷Δt="(0.5mol÷2L)÷5min=0.05" mol/(L·min)。(2)A.根据反应方程式可知:消耗1 mol N2同时就消耗1 mol O2,还生成1 mol O2,则氧气的消耗速率与产生速率相等,反应达到平衡状态,正确;B.因为反应是在恒容条件下进行,反应前后气体的质量也不变,所以无论反应是否达到平衡,混合气体密度不变,因此不能作为判断平衡的标志,错误;C.因为气体的物质的量不变,质量也不变,所以混合气体平均相对分子质量不变不能作为判断平
本题难度:一般
5、选择题 一定温度下,可逆反应3X(g)+Y(g)
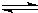
2Z(g)达到限度的标志是( )
A.单位时间内生成3nmolX,同时消耗nmolY
B.X、Y、Z的浓度相等
C.X的生成速率与Z的生成速率相等
D.X、Y、Z的分子个数比为3:1:2
参考答案:A.单位时间内生成3nmolX,同时消耗nmolY,可说明正
本题解析:
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772