微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 “飘尘”是物质燃烧时产生的粒状漂浮物,颗粒很小(直径小于10-7 m),不易沉降(可漂浮数小时甚至数年),它与空气中的SO2、O2接触时,SO2会转化为SO3,使空气酸度增加。飘尘所起的主要作用与下列变化中硫酸的作用相同的是( )。
A.氯气除杂过程中通入浓硫酸中
B.浓硫酸与木炭共热
C.乙酸乙酯与稀硫酸共热
D.浓硫酸滴到蔗糖中制“黑面包”
参考答案:C
本题解析:“飘尘”与空气中的SO2、O2接触时,SO2会转化为SO3,则“飘尘”在该反应中起催化作用。氯气通入浓硫酸中除水蒸气,浓硫酸表现了吸水性;浓硫酸与木炭共热,浓硫酸表现了强氧化性;乙酸乙酯与稀硫酸共热时,乙酸乙酯水解,稀硫酸起催化作用;浓硫酸滴到蔗糖中制“黑面包”时,浓硫酸表现了脱水性。
本题难度:一般
2、实验题 (16分)某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:
【实验推测】足量的铁粉与浓硫酸反应能生成SO2和H2两种气体。
(1)该小组作出此推测的理由是:???????????????????????????????。
【实验准备】a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2 mol/L的H2C2O4标准溶液、0.1 mol/L的酸性KMnO4标准溶液、酸碱指示剂。
b.实验装置设计及组装(加热及夹持装置均已略去)
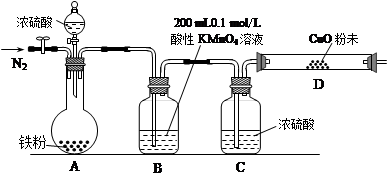
【实验过程及数据处理】
(2)B中发生反应的离子方程式为:??????????????????????????????????????。
(3)实验前先通入一段时间的N2,其目的是?????????????????????。
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是????????
???????????????????????????????????????????。
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25 mL,用H2C2O4标准溶液进行滴定。
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平。
(? )H2C2O4+(? )MnO4- +(? )H+ =(? )Mn2+ +(? ) H2O+(? ) (?????? )
②滴定达到终点时的现象是???????????????????????????????。
③重复滴定两次,平均每次耗用H2C2O4标准溶液15.63 mL,则铁与浓硫酸反应产生的SO2气体的物质的量为???????????????;经称量,实验前后装置D的质量减少0.9 g,则产生的气体中SO2的体积分数为???????????。
参考答案:(16分)(1)在加热的条件下浓硫酸与Fe反应生成SO2,随
本题解析:(1)由于在加热的条件下浓硫酸与Fe反应生成SO2,随着反应的进行,硫酸浓度变稀,
与Fe反应生成H2。
(2)酸性高锰酸钾溶液具有氧化性,能氧化SO2,所以方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+。
(3)由于空气中含有氧气,在加热的条件下容易和氢气发生爆炸,所以通入氮气是为了排除装置中的空气,防止H2与空气混合受热发生爆炸。
(4)SO2具有还原性,能使酸性高锰酸钾溶液褪色。氢气具有还原性,能使黑色氧化铜还原成红色的铜。
(5)①在反应中
本题难度:一般
3、选择题 17.2 g CaSO4·xH2O转变成2CaSO4·(x-1)H2O时,质量减少2.7 g,则x值是(???)
A.1
B.2
C.4
D.6
参考答案:B
本题解析:写出反应方程式,根据差量法计算。
2(CaSO4·xH2O)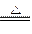 2CaSO4·(x-1)H2O+(x+1)H2O
2CaSO4·(x-1)H2O+(x+1)H2O
2(136+18x) g?????????????????????18(x+1) g
17.2 g??????????????????????????2.7g
求得?x=2
本题难度:简单
4、选择题 将90%H2SO4溶液和10%H2SO4溶液等体积混合,所得溶液的百分比浓度为( )
A.小于50%
B.大于50%
C.等于50%
D.不能确定
参考答案:B
本题解析:设各取体积为 L,90%H2SO4密度为
L,90%H2SO4密度为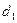 ,10%H2SO4密度为
,10%H2SO4密度为 本题难度:简单
本题难度:简单
5、选择题 工业上用来贮存和运输浓硫酸、浓硝酸的容器能用以下(??????? )材料制造的。
A.玻璃
B.铝
C.铁
D.铜
参考答案:BC
本题解析:玻璃易碎,铜能溶于硝酸,铝、铁在浓硫酸和浓硝酸中发生钝化,可原来贮存和运输浓硫酸、浓硝酸的容器,答案选BC。
本题难度:简单