微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知Na2SO3在空气中易被氧化为Na2SO4,现有一包包装破损的白色Na2SO3固体粉末,为了检验其是否变 质,正确的方法是
质,正确的方法是
A.取少量样品于试管中,滴入稀盐酸,无沉淀,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。
B.取少量样品于试管中,滴入稀硝酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。
C.取少量样品于试管中,滴入稀硫酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。
D.取少量样品于试管中,滴入稀盐酸,若产生使品红溶液褪色的气体,则说明已变质
参考答案:A
本题解析:略
本题难度:一般
2、选择题 将等物质的量的SO2和Cl2混合后通入含有品红和Ba(NO3)2的混合溶液里,发生的现象是???????????????????????????????????????????????????????????????
①溶液很快褪色 ②溶液不褪色 ③有沉淀生成 ④溶液仍然透明???????
A.仅①和④
B.仅①和③
C.仅②和③
D.仅②和④
参考答案:C
本题解析:氯气具有氧化性能氧化二氧化硫生成硫酸,反应式为SO2+H2O+Cl2=2HCl+H2SO4,因此所得溶液没有漂白性,有白色硫酸钡沉淀生成。答案选C。
本题难度:一般
3、计算题 Na2SO3在30℃时的溶解度为35.5克/100克水。
(1)计算30℃时Na2SO3饱和溶液的质量分数。(保留两位小数)
(2)计算30℃时271克Na2SO3饱和溶液中水的质量。
(3)的将30℃时271克Na2SO3饱和溶液冷却到10℃,析出Na2SO3·7H2O晶体79.5克。计算10℃时Na2SO3在水中的溶解度。
参考答案:(1)35.5/135.5*100%=26.20%
(
本题解析:略
本题难度:简单
4、选择题 有下列两种转化途径,某些反应条件和产物已省略,下列有关说法不正确的是
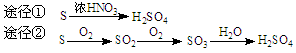
A.途径①反应中体现了浓HNO3的强氧化性和酸性
B.途径②的第二步反应在实际生产中可以通过增大O2浓度来降低成本
C.由途径①和②分别制取1 mol H2SO4,理论上各消耗1 mol S,各转移6 mol e-
D.途径②与途径①相比更能体现“绿色化学”的理念是因为途径②比途径①污染相对小且原子利用率高
参考答案:A
本题解析:
答案:A
A、不正确,途径①反应中只体现了浓HNO3的强氧化性,参加反应的HNO3中N全部变价。
本题难度:一般
5、计算题 在氧气中充分燃烧1克含杂质的硫铁矿试样,得到残余固体0.76克(假设杂质不参加反应),问生产10吨98%的浓硫酸需要这种矿石多少吨?(反应过程中硫损失2%)
参考答案:需该矿石8.5吨。
本题解析:
高温
本题难度:简单