微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业生产金刚砂(SiC中Si为+4价,C为—4价)的化学方程式为?
SiO2?+? 3C? ==? SiC? +? 2CO↑
在这个反应中,氧化剂和还原剂的质量比
A.2 :1
B.1 :2
C.5 :3
D.3 :5
参考答案:B
本题解析:
试题分析:在反应中,硅的化合价没变化,碳的化合价有升高有降低,所以碳既是氧化剂又是还原剂,从生成物上分析可以看到: C?→? SiC 化合价升高,做还原剂?? 2C?→? 2CO 化合价降低,做氧化剂。所以氧化剂和还原剂的质量比等于物质的量之比等于1 :2,故选B。
点评:氧化还原反应的规律是:氧化剂得电子,化合价降低,具有较强氧化性;还原剂失电子,化合价升高,具有较强还原性。
本题难度:一般
2、填空题 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=???__。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为???????????????。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2??????? b.NH4HSO4
c.(NH4) 2SO4?????????????d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为???__(填选项字母)。
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为???__。
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为???__,电解过程中阴极附近溶液的pH将???__(填“增大”“减小”或“不变”)。
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以???__为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应)???__(列式并计算)。
参考答案:(1)2.2×10-8mol/L
(2)①取少量晶体,
本题解析:(1)Ksp=c(Ba2+)·c(SO42-),所以c(Ba2+)=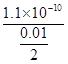 mol/L=2.2×10-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH4+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO4-;②阳极失电子化合价升高:2SO42--
mol/L=2.2×10-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH4+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO4-;②阳极失电子化合价升高:2SO42--
本题难度:一般
3、选择题 下列叙述正确的是( )。
A.阳离子只有氧化性,阴离子只有还原性
B.含氧酸可作氧化剂而无氧酸不能
C.在8NH3+3Cl2=N2+6NH4Cl反应中氧化剂与还原剂物质的量之比是2∶3
D.已知还原性:Fe2+>Br-,可知反应2Fe3++2Br-=2Fe2++Br2不易进行
参考答案:D
本题解析:Fe2+既有氧化性又有还原性,故A不对;只要是酸就有氧化性,故B不对;C中的氧化剂是氯气,还原剂是氨气,二者的物质的量之比是3∶2。
本题难度:一般
4、选择题 火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1molCu2S,有4mol硫被氧化
D.每转移1.2mol电子,有0.2mol硫被氧化
参考答案:D
本题解析:依题意知,Cu从+2价降低为Cu2S中+1价,S从-2价升高到SO2中的+4价;氧元素化合价降低。SO2既是氧化产物又是还原产物;CuFeS2既是氧化剂又是还原剂;每生成1 molCu2S,有1mol硫被氧化。S元素由-2价升高到+4价,该反应中转移电子数是6,所以每转移1.2 mol电子,则有0.2 mol硫被氧化,故D正确;
本题难度:一般
5、填空题 (12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑???????还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式:???????????????????????????。
(2)反应中氧化剂是???????;氧化产物是???????;若有0.5molH2O2参加此反应,电子一转移个数为??????????????????。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为????????????????????????;这时若有0.5molH2O2发生分解,电子转移个数为????????????????????。
参考答案:(1)2MnO4- +5H2O2+6H+ =2Mn2+ +8
本题解析:(1)根据已知的还原反应和氧化反应以及电子得失守恒可知,反应的离子方程式为2MnO4- +5H2O2+6H+ =2Mn2+ +8H2O+5O2↑。
(2)高锰酸钾中锰元素的化合价从+7价降低到+2价,所以高锰酸钾是氧化剂。双氧水中氧元素从-1价升高到0价,失去2个电子,因此氧化产物是氧气。有0.5molH2O2参加此反应,转移电子是0.5mol×2=1.0mol,个数是NA。
(3)双氧水分解的方程式为2H2O2=2H2O+ O2↑。在双氧水的分解中每生成1mol氧气,转移2mol电子,消耗2
本题难度:一般