微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸, 所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
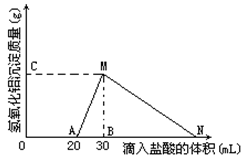
问:
(1)此溶液中同时含有____mol___???离子;
(2)用离子方程式表示MN段发生的反应是????????????
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)=???????????
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为???????????????mL
参考答案:(1)0.02mol;OH-?????? (2)Al(OH)
本题解析:
试题分析::(1)由图可知,滴加盐酸开始不产生沉淀,故溶液中还含有OH-,开始加入的20mL盐酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)=n(H+)=0.02L×1mol/L=0.02mol,
故答案为:0.02;OH-;
(2)由图可知,MN段是氢氧化铝与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)由图可知,从20mL~40mL发生的反应为AlO2
本题难度:一般
2、填空题 (12分)同温同压下,同体积的N2和SO2分子数之比为 ,物质的量之比为 ,原子总数之比为 ,摩尔质量之比为 ,质量之比为 ,密度之比为 。
参考答案:1∶1 , 1∶1 , 2∶
本题解析:
试题分析:根据阿伏伽德罗定律,同温同压下,同体积的N2和SO2,一定有相同的分子数(相同物质的量),同温同压下,气体的密度比等于摩尔质量之比;N2的摩尔质量为28g/mol、SO2的摩尔质量为64g/mol。
考点:本题考查阿伏加德罗定律。
本题难度:一般
3、实验题 某次实验需用0.4 mol/L NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;???
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;用少量蒸馏水洗涤烧杯??????????次,洗涤后的溶液一并转入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;向容量瓶中加入蒸馏水,到液面_____________________时,改用__________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
参考答案:(1)500
(2)8.0?
(3)待冷却至室温
本题解析:
试题分析:(1)因溶液的体积480mL,但容量瓶的规格没有480mL,所以选用500mL容量瓶,故答案为:500mL;
(2)需氢氧化钠的质量为m=0.5L×0.4mol?L-1×40g/mol=8.0g,故答案为:8.0;
(3)氢氧化钠溶解放出大量的热,溶液具有热胀冷缩的性质,影响溶液体积,故应先冷却至室温,故答案为:待溶液冷却至室温;
(4)为保证溶质尽可能转移到容量瓶中,需用少量蒸馏水洗涤烧杯2-3?次,并将洗涤液一起转入容量瓶中,故答案为:蒸馏水;一起转入容量瓶中;
本题难度:一般
4、填空题 (4分)0.2molO3和0.3molO2的质量 (选填“相等”、“不相等”或“无法判断”),分子数之比为 ,所含原子数之比为 ,在相同条件下的体积之比为 。
参考答案:相等、2:3 、 1:1 &
本题解析:略
本题难度:一般
5、选择题 下列溶液中Cl-的物质的量浓度最大的是( )
A.200mL 2mol/L MgCl2溶液
B.1000mL 2.5mol/L NaCl溶液
C.250mL 1mol/L AlCl3溶液
D.300mL 5mol/L KClO3溶液
参考答案:A
本题解析:
试题分析:根据溶质的物质的量浓度和物质的构成可知,c(Cl-)=c(溶质)×氯离子的个数,然后比较可知氯离子浓度最大的。A项c(Cl-)=2mol/L×2=4mol/L;B项c(Cl-)=2.5mol/L×1=2.5mol/L;C项c(Cl-)=1mol/L×3=3mol/L;D项KClO3溶液中不电离生成氯离子;显然A中氯离子浓度最大,故选A。
考点:物质的量浓度的相关计算
点评:本题考查物质的量浓度的计算,明确离子浓度与物质的构成的关系是解答本题的关键,注意离子浓度与溶质的浓度有关,而与溶液的体积无关。属于较简单题。
本题难度:一般