微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,46gNO2和N2O4混合气体中含有的分子数为NA
B.标况下,2.24L的H2O所含氢原子数大于0.2NA
C.常温下1L0.1 mol/L醋酸溶液中,水电离的氢离子数为10—13NA
D.水蒸气通过足量Na2O2使其增重ag时,转移的电子数为aNA
参考答案:B
本题解析:考查阿伏加德罗常数的应用。选项A不正确,二者的相对分子质量不相等,混合气的物质的量不能确定;标准状况下,2.24L水的物质的量要大于0.1mol,B正确;醋酸是弱酸,溶液中氢离子的浓度小于0.1mol/L,所以水电离的氢离子数小于10—13NA,选项C不正确;过氧化钠与水蒸气反应的方程式是2Na2O2+2H2O=4NaOH+O2,反应中过氧化钠既是氧化剂,也是还原剂,转移1个电子。增重ag时,参加反应的过氧化钠是a/2mol,所以转移电子的物质的量是a/2mol,答案选B。
本题难度:一般
2、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A.用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属
B.l mol C22H46中含有的C—C键个数约为21×6.02×1023
C.0.1mol 24Mg32S晶体中所含中子总数为28×6.02×1023
D.1 mol Na2O2中所含的阴离子数约为2×6.02×1023
参考答案:B
本题解析:A错,阴极电极反应式为:2H++2e—=H2;无金属析出;B正确;C错,0.1mol 24Mg32S晶体中所含中子总数为2.8×6.02×1023;D错,Na2O2中阳离子与阴离子个数比为2:1,1 mol Na2O2中所含的阴离子数约为6.02×1023
本题难度:一般
3、选择题 有一瓶14%的氢氧化钾溶液,加热蒸发掉100g水后,得到28%的氢氧化钾溶液80mL,所得溶液的浓度为( )
A.5mol/L
B.6mol/L
C.6.25mol/L
D.6.5mol/L
参考答案:设14%氢氧化钾溶液的质量为x,蒸发前后溶质的质量不变,则有
本题解析:
本题难度:一般
4、选择题 同温、同压下,相同体积的下列气体质量最大的是( )
A.氧气
B.甲烷
C.二氧化碳
D.氯气
参考答案:同温、同压下,相同体积,则具有相同的物质的量,由m=nM可知
本题解析:
本题难度:一般
5、填空题 Na、Mg、Al分别与盐酸反应。?
(1)若盐酸足量,等物质的量的Na、Mg、Al产生的氢气质量之比为_______________。
(2)若盐酸足量,等质量的Na、Mg、Al产生H2的质量之比为_______________,溶液增重质量之比为_______________。?
(3)若盐酸等质量且足量,充分反应后所得溶液质量相等,则Na、Mg、Al质量之比为_______________。?
(4)若盐酸浓度相等,体积相等,投入的Na、Mg、Al质量相等,反应后有一种金属剩余,该金属是_______________。?
(5)称取Na、Mg、Al各m g,在室温下分别与V L 4 mol·L-1的盐酸充分反应,试推断,在下列三种情况下,V的取值范围(用含m的表达式表示)。
①Al与盐酸反应放出H2最多时,______________。?
②Na与盐酸反应放出H2最多时,______________。?
③Mg和Al与盐酸反应产生H2一样多时,______________。?
参考答案:(1)1∶2∶3??
(2) 本题解析:(1)盐酸足量,有下列关系:?
本题解析:(1)盐酸足量,有下列关系:?
2Na+2HCl====2NaCl+H2↑
1 mol??????????????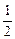 ?mol?
?mol?
Mg+2HCl====MgCl2+H2↑
1 mol????????????1 mol
2Al+6HCl====2AlCl3+3H2↑?
1 mol?
本题难度:简单