微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用铝箔包装0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到气体(标准状况下)为(??)
A.H2、O2混合气体
B.1.12L H2
C.>1.12L H2
D.<1.12L H2
参考答案:C
本题解析:
正确答案:C
由2Na+2H2O=2NaOH+H2↑可知,0.1mol金属钠产生0.05molH2,但生成的NaOH又与Al反应产生H2,故C正确。
本题难度:简单
2、选择题 核磁共振造影增强剂用于疾病诊断,还可作为药物载体用于疾病的治疗。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:

下列有关叙述不合理的是:(???)????????????????????
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.反应③的化学方程式是:6FeOOH+CO=2Fe3O4+3H2O+CO2
C.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
D.在反应②环丙胺的作用可能是促进氯化铁水解
参考答案:C
本题解析:C选项不合理,纳米四氧化三铁分散在适当溶剂中,它与胶体分散质直径相当;
本题难度:困难
3、填空题 金属铜不溶于稀硫酸,可溶于铁盐溶液生成铜盐与亚铁盐.现将一定量的铜片加入到100 mL稀硫酸和硫酸铁的混合液中,铜片完全溶解(不考虑盐的水解及溶液体积的变化)
(1)写出铜溶解于上述混合液的离子方程式____________________________.
(2)若铜完全溶解时,溶液中的Fe3+、Cu2+、H+三种离子的物质的量浓度相等,且测得溶液的pH=1,则溶解铜的质量是______g,溶液中的c(SO)=______mol/L.
(3)若欲在如图所示的装置中发生(1)中的反应,请判断图中的正、负极,并选出适当的物质作电极,写出电极反应式,填在相应的表格中.
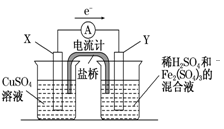
?
| 正、负极判断
| 电极材料
| 电极反应式
|
X极
| ?
| ?
| ?
|
Y极
| ?
| ?
| ?
参考答案:(1)Cu+2Fe3+===Cu2++2Fe2+
(2
本题解析:
考查知识点:离子反应;电化学基础;
解答过程:(1)混合液中存在H2SO4和Fe2(SO4)3,铜为不活泼金属,不与H2SO4反应;但Fe3+具有氧化性,可将铜单质氧化为铜离子:Cu+2Fe3+===Cu2++2Fe2+ 。
(2)pH=1,则c(H+)=0.1mol/L;则c(Cu2+)=c(H+)=0.1mol/L;则反应生成的铜离子的物质的量为n(Cu2+)=0.1mol/L×100×10—3L="0.01mol" 。
设反应消耗的铜、Fe3+的物质的量为a、b
C
本题难度:一般
4、选择题 下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是(??)
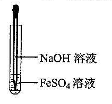
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用右图所示装置,制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
参考答案:B
本题解析:
试题分析:氢氧化亚铁极易被空气氧化生成氢氧化铁,A正确;氢氧化亚铁是一种白色沉淀,B不正确;由于氢氧化亚铁极易被氧化,所以滴管应该插在溶液下面,C正确;D正确,煮沸的目的是排出溶液中溶解的氧气,防止氧化氢氧化亚铁,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点。该题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力。
本题难度:简单
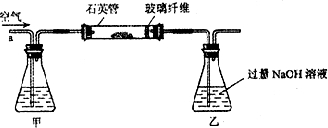
5、简答题 黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
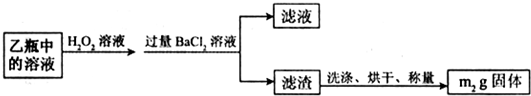
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
(1)I中,甲瓶内所盛试剂是______溶液.乙瓶内发生反应的离子方程式有______、______.
(2)Ⅱ中,所需H2O2溶液足量的理由是______.
(3)该黄铁矿石中硫元素的质量分数为______.
[实验二]:设计以下实验方案测定铁元素的含量
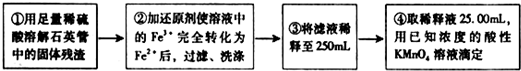
问题讨论:
(4)②中,若选用铁粉作还原剂.你认为合理吗?______.
若不合理,会如何影响测量结果:______(若合理,此空不答).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______.
(6)④中发生反应的离子方程式为______.
参考答案:(1)空气中含有二氧化碳,能和乙中的氢氧化钠反应生成碳酸钠,
本题解析:
本题难度:一般
|