微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式的书写及评价均合理的是(???)
选项
| 离子方程式
| 评价
|
A
| 将2molCl2通入到含1molFeI2的溶液中:
,2Fe2++2I—+2Cl2 = 2Fe3++4Cl-+I2,
| 正确;Cl2过量,可将Fe2+ 、I—均氧化
|
B
| Mg(HCO3)2溶液与足量的NaOH溶液反应:
Mg2++ HCO3—+ OH—=" " MgCO3↓+ H2O
| 正确;酸式盐与碱反应生成正盐和水
|
C
| 过量SO2通入到NaClO溶液中:
SO2 + H2O + ClO-?= HClO+HSO3-
| 正确; 说明酸性:
H2SO3强于HClO
|
D
| 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ 3H2O
| 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3
?
参考答案:D
本题解析:
试题分析:A项的离子方程式为2Fe2++4I—+3Cl2 = 2Fe3++6Cl-+2I2,B项足量NaOH应该生成Mg(OH)2,C项HClO具有强氧化性将HSO3-,氧化为SO42-,错误。
本题难度:一般
2、计算题 Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
阴离子
| SO42-、NO3-、Cl-
| 阳离子
| Fe3+、Fe2+、NH4+、Cu2+、Al3+
①若向原溶液中加入KSCN溶液,无明显变化。②若向原溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变。③若向原溶液中加入BaCl2溶液,有白色沉淀生成。试回答下列问题
(1)若先向原溶液中加入过量的盐酸,再加入KSCN溶液,现象是 。
(2)原溶液中含有的阳离子是 。
(3)向原溶液中加入足量的盐酸,发生反应的离子方程式为 。
(4)向原溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体用托盘天平称量质量为 。
Ⅱ. 草酸亚铁晶体(FeC2O4·2H2O)、碳酸锂和二氧化硅在氩气中高温反应可制备锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)。草酸亚铁晶体在氩气气氛中进行热重分析,结果如右图所示(TG%表示残留固体质量占原样品总质量的百分数),请回答下列问题:

(5)草酸亚铁晶体中碳元素的化合价为:
(6)A→B发生反应的化学方程式为 。
(7)精确研究表明,B→C实际是分两步进行的,每一步只释放一种气体,第二步释放的气体的相对分子质量较第一步的大,则第一步释放的气体化学式为: ;释放第二种气体时,反应的化学方程式为 。
参考答案:(16分,每空2分)(1)溶液呈红色(2分) &#
本题解析:
试题分析:Ⅰ.若向溶液中加入KSCN溶液,无明显变化,说明原溶液中不含Fe3+;若向溶液中加入过量的盐酸,有气体生成,溶液中阴离子种类不变,说明原溶液中含有Cl-,该气体只能是NO,说明含有具有氧化性的NO3-和具有还原性的Fe2+。若向溶液中加入BaCl2溶液,有白色沉淀生成,说明原溶液中含有SO42-。各离子的物质的量均为1mol,因此根据电荷守恒可知还应含有Cu2+,所以原溶液中所含阳离子是Fe2+、Cu2+,阴离子是NO3-、Cl-、SO42-。
(1)如果先加入盐酸,在酸性条件下NO3-具有氧化性,能和具有还原性的Fe2+发生氧化还原反应,反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。所以再滴入KSCN溶液,溶液呈红色。
(2)原溶液中含有的阳离子是Fe2+和Cu2+。
(3)根据以上分析可知,向原溶液中加入足量的盐酸,发生反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。
(4)原溶液中所含阳离子是Fe2+、Cu2+,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,最终得到的固体应该是是CuO、Fe2O3。根据题意各离子的物质的量均为1mol可知,m(CuO)=1.0mol×80g/mol=80.0g,m(Fe2O3)=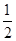 ×1.0mol×160g/mol=80.0g,所得固体的质量为80.0g+80.0g=160.0g。 ×1.0mol×160g/mol=80.0g,所得固体的质量为80.0g+80.0g=160.0g。
Ⅱ.(5)草酸亚铁晶体(FeC2O4·2H2O)中铁元素的化合价是+2价,氧元素是-2价,所以碳元素的化合价是(2×4-2)÷2=+3价。
(6)根据草酸亚铁晶体的化学式FeC2O4·2H2O可知,晶体中结晶水的含量是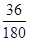 ×100%=20%,所以A→B发生反应恰好是失去结晶水,因此反应的化学方程式为FeC2O4·2H2O ×100%=20%,所以A→B发生反应恰好是失去结晶水,因此反应的化学方程式为FeC2O4·2H2O FeC2O4 +2H2O。 FeC2O4 +2H2O。
(7)草酸亚铁晶体中FeO的含量是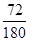 ×100%=40%,所以C点生成的固体是氧化亚铁。由于第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的是CO,第二步释放的是CO2,反应的化学方程式分别是FeC2O4 ×100%=40%,所以C点生成的固体是氧化亚铁。由于第二步释放的气体的相对分子质量较第一步的大,所以第一步释放的是CO,第二步释放的是CO2,反应的化学方程式分别是FeC2O4 FeCO3+CO、FeCO3 FeCO3+CO、FeCO3 FeO + CO2↑。 FeO + CO2↑。
考点:考查离子共存和检验;方程式的书写;化学计算;化合价的判断以及物质含量的有关计算和判断
本题难度:困难
3、选择题 下列的离子组中,在溶液中能大量共存是
A.NH4+、Al3+、SO42-、HCO3-
B.K+、Al3+、AlO2-、NO3-
C.Fe3+、H+、NO3-、SO42-
D.H+、Na+、SO42-、S2O32-
参考答案:C
本题解析:
试题分析:A、铝离子和碳酸氢根离子双水解而不共存,不选A;B、铝离子和偏铝酸根离子反应而不共存,不选B;C、四种离子不反应,选C;D、氢离子和S2O32-反应,不选D。
考点:离子共存。
本题难度:一般
4、选择题 在无色溶液中,下列离子能大量共存的是
A.Na+、NH4+ 、NO3-、MnO4-
B.K +、SO42-、OH-、AlO2-
C.K +、Fe3+ 、Cl-、Br-
D.Ba2+ 、Na+ 、OH-、CO32-
参考答案:B
本题解析:A:MnO4-呈紫色,排除
B:正确
C:Fe3+ 呈棕黄色,且可氧化Br-,排除
D:Ba2+ 与CO32-将形成沉淀,排除
答案为B
本题难度:简单
5、选择题 下列有关实验的叙述中,合理的是
①用pH试纸测得某新制氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度
A.②④⑥
B.②③⑥
C.①②④
D.②③④⑤⑥
参考答案:A
本题解析:新制氯水具有氧化性,能氧化酸碱指示剂,①不正确。瓷坩埚中含有二氧化硅,高温下能和氢氧化钠反应,②正确。③不正确,应该是查漏。酸性高锰酸钾溶液能发生橡胶,应该用酸式滴定管,④正确。使用pH试纸测定溶液pH时试纸不能先润湿,⑤不正确。氯化铁水解生成氢氧化铁和氯化氢,所以配制时要防止水解,⑥正确,答案选A。
本题难度:简单
|
|