微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
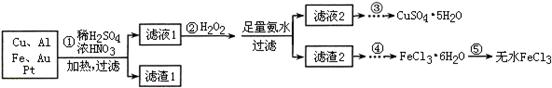
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗Na2S2O3标准溶液(mL)
| 25.00
| 25.02
| 26.20
| 24.98
此产品中CuSO4·5H2O的质量分数为 。
参考答案:(1)Cu + 4H+ + 2NO3? = Cu2+ +2N
本题解析:
试题分析:(1)浓硝酸与稀硫酸混合后,可能为浓硝酸也可能为稀硝酸,所以离子方程式为:Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O或3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O 3Cu2++2NO↑+4H2O
(2)H2O2具有强氧化性,所以H2O2的作用是将Fe2+氧化成Fe3+;加入足量氨水,Fe3+、Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,所以滤渣2为Fe(OH)3、Al(OH)3。
(3)FeCl3为强酸弱碱盐,容易发生水解反应:FeCl3+3H2O  Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。 Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
(4)c2(OH?)?c(Cu2+)= Ksp[Cu(OH)2],代入数据可求出c(OH?)=1.0×10-9mol?L?1,pH=-lgc(H+)=-lg【Kw÷c(OH?)】=5。
(5)Cu2+把I?氧化为I2,加入淀粉溶液变蓝,用Na2S2O3标准溶液滴定,达到滴定终点时,Na2S2O3与I2恰好完全反应,所以达到滴定终点的依据是:溶液由蓝色褪为无色且半分钟内不恢复原色;实验3所测数据明显大于其他3组数据,说明实验3出现了实验错误,应舍去,根据其他3组数据求出平均值,根据2Cu2++4I-= 2CuI↓+I2和I2+2S2O32-= 2I-+S4O62-可得对应关系:S2O32- ~ Cu2+,所以n(CuSO4?5H2O)=n(Cu2+)=n(S2O32- )=0.080 mol·L-1 ×(25.00+25.02+24.98)/3L=0.002mol,所以此产品中CuSO4·5H2O的质量分数为:0.002mol×250g/mol×5÷3.00g×100%=83.3%
考点:本题考查化学流程的分析、化学方程式的书写、盐类水解的应用、pH的计算、氧化还原反应滴定及计算。
本题难度:困难
2、选择题 用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
参考答案:A、D、E
本题解析:
试题分析: 配制标准溶液的氢氧化钠中混有Na2CO3杂质,由于氢氧化钠的性对分子量为40,而碳酸钠的性对分子量为100,而消耗盐酸时两个氢氧化钠分子与一个碳酸钠分子相同,故折算起来的标准的氢氧化钠的浓度偏小,所以测定的结果就偏高,故A可以选择; 滴定终点读数时,俯视滴定管的刻度,则实际的读数变小了,故测得的浓度偏低,B不能选;盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗为正确操作,对结果不会发生影响,故C不能选;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,则实际的读数比真实的读数大,故测定的结构偏大,故D可以选择;未用标准液润洗碱式滴定管,则标准氢氧化钠的浓度变小,故测得的结果偏大,所以本题的答案选择ADF。
考点:酸碱滴定
点评:本题考查了酸碱滴定,酸碱滴定是历年高考考查的重点,本题侧重考查学生的分析能量,该题难度中等,特别是A选择分析的难度稍微大一点。
本题难度:一般
3、选择题 下列表述中,合理的是( ) A.准确量取20.00mL高锰酸钾溶液,可选用25?mL碱式滴定管
B.将水加热,Kw增大,pH变大
C.用惰性电极电解1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2mol电子转移时,阴极析出6.4g金属
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
参考答案:D
本题解析:
本题难度:简单
4、选择题 常温下,甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列叙述的判断正确的是 ( )
A.甲中水电离出来的H+ 的物质的量浓度是乙中水电离出来的H+ 的物质的量浓度的10倍
B.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)=V(乙)
C.物质的量浓度c(甲)>10c(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
参考答案:C
本题解析:略
本题难度:困难
5、选择题 室温时,将xmLpH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7
B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7
D.若x=10y,且a+b=14,则pH>7
参考答案:D
本题解析:
试题分析:由题可知,n(NaOH)=x×10-3×10a-14mol,n(HCl)= y×10-3×10-bmol。
故 ,分步讨论: ,分步讨论:
(1)若x=y,,则n(NaOH)=n(HCl),二者恰好反应,pH=7
(2)若10x=y,且a+b=13,则n(HCl)=100n(NaOH),HCl过量,pH<7
(3)若ax=by,且a+b=13,则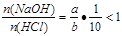 (因a>7,b<7),HCl过量, (因a>7,b<7),HCl过量,
(4)若x=10y,且a+b=14,则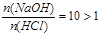 ,NaOH过量,pH>7 ,NaOH过量,pH>7
所以答案选D。
考点:混合溶液pH的计算
点评:混合溶液pH的计算要注意过量问题。
本题难度:一般
|