微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于pH=3的盐酸和醋酸溶液的说法正确的是
A.两种溶液中由水电离出来的c(H+)不相同
B.中和相同体积的两种酸溶液所需NaOH的物质的量分别为a和b,则a<b
C.加入足量的铁粉,放出H2的体积相同
D.分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,则m=n
参考答案:B
本题解析:
试题分析:A、两种溶液中由水电离出来的c(H+)相同都是10-3mol·L-1·,错误;B、中和相同体积的两种酸溶液所需NaOH的物质的量分别为a和b,由于醋酸是弱酸,故需要的NaOH的量多,即a<b,正确;C、加入足量的铁粉,没有说明酸的体积,所以放出H2的体积无法判断,错误;D、分别用蒸馏水稀释m倍和n倍,两溶液pH仍相同,由于醋酸是弱酸,加水稀释后又电离,应多加水稀释,即m<n,错误。
考点: 强酸与弱酸比较。
本题难度:一般
2、选择题 常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是
A.c(H+)
B.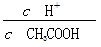
C.c(H+)·c(OH-)
D.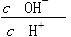
参考答案:A
本题解析:B项变形,分子、分母同乘以溶液中的c(CH3COO-),
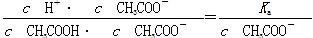
由于加水稀释时,c(CH3COO-)变小,因而B项比值增大;C项是Kw,不受浓度的影响;D项变形,分子、分母同乘以溶液中的c(H+),得 本题难度:一般
本题难度:一般
3、填空题 下表是几种常见弱酸的电离平衡常数(25℃)。
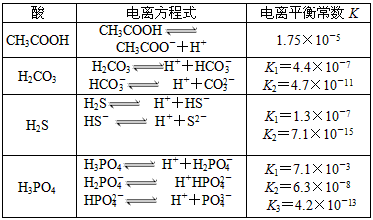
回答下列各题:
(1)当温度升高时,K值__________(填“增大”、“减小”或“不变”)。
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?
__________________。
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO3-、HPO32-都看作是酸,其中酸性最强的是__________,最弱的是__________。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律是__________________,产生此规律的原因是__________________________________。
参考答案:(1)增大
(2)K值越大,电离出的氢离子浓度越大,所
本题解析:
本题难度:一般
4、选择题 已知25℃时有关弱酸的电离平衡常数:
弱酸
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数
| 1.8×l0-5
| 4.9×l0-10
| K1=4.3×l0-7??K2=5.6×l0-11
?
25℃下,下列有关说法正确的是
A.浓度为0.1mol/L的HCN溶液中c(OH-)=10-13mol/L
B.物质的量浓度相同的稀酸溶液中KW:CH3COOH>H2CO3>HCN
C.物质的量浓度相同的三种钠盐溶液的pH:NaHCO3>NaCN>CH3COONa
D.浓度均为amol?L-1HCN溶液与NaOH溶液等体积混合充分反应后的溶液中(忽略体积的变化)c(H+)<c(OH-)<c(CN-)<0.5amol/L
参考答案:D
本题解析:
试题分析:A、根据电离平衡常数可知,HCN的酸性弱于醋酸的,因此HCN是弱酸,则浓度为0.1mol/L的HCN溶液中c(OH-)>10-13mol/L,A不正确;B、水的离子积常数只与温度有关系,常温下物质的量浓度相同的稀酸溶液中KW:CH3COOH=H2CO3=HCN,B不正确;C、根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HCN。由于酸越弱,相应的钠盐越容易水解,溶液的碱性越强,所以物质的量浓度相同的三种钠盐溶液的pH:NaCN>NaHCO3>CH3COONa,C不正确;
本题难度:一般
5、选择题 下列有关叙述正确的是 (??)
A.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)= c(HCO )+c(H2CO3) )+c(H2CO3)
B.pH=4.5的柠檬汁中c(H+)是pH=6.5的番茄汁中c(H+)的100倍
C.100 ml pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气较多,说明HA的酸性比HB的强
D.pH=5.5的CH3COOH与CH3COONa混合溶液中:c(Na+)> c(CH3COO-)
参考答案:B
本题解析:
试题分析:A、根据元素守恒规律,应有c(HClO)+c(ClO-)= c(HCO )+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶 )+c(H2CO3)+ c(CO32-),错误;B、pH=4.5的柠檬汁中c(H+)=1×10-4.5mol/L,pH=6.5的番茄汁中c(H+)=1×10-6.5mol/L,前者是后者的100倍,正确;C、HA溶液、HB溶
本题难度:一般
|