微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,5.6 LNO和16.8 LO2的混合气体中含有分子数为NA
B.0.1 mol Fe在氧气中充分燃烧失电子数为0.3NA
C.在1 L lmol·L-1的氨水中,含有的NH3与NH3·H2O分子的总数为NA
D.标准状况下,40gSO3所占的体积一定小于11.2 L
参考答案:D
本题解析:
试题分析:NO和O2反应生成NO2,故A错误;Fe在氧气中充分燃烧,生成Fe3O4,0.1 mol Fe在氧气中充分燃烧失电子数为0.8NA/3,故B错误;在1 L lmol·L-1的氨水中,含有的NH3与NH3·H2O、NH4+的总数为NA,故C错误;标准状况下SO3为液体,故D正确。
考点:本题考查阿伏伽德罗常数。
本题难度:一般
2、选择题 设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )。
A.1 mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28g混合气体中含有3nA个氢原子
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为nA
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1nA个Fe3+
参考答案:C
本题解析:A不正确,阴离子是SO32-,带有2mol负电荷;乙烯和环丙烷的最简式都是CH2,所以28g混合物中4mol氢原子;氯气和氢氧化钠的反应中,氯气既是氧化剂,也是还原剂,转移1个电子;氯化铜溶于水,Fe3+水解,所以溶液中Fe3+的物质的量小于0.1mol,D不正确,答案选C。
本题难度:一般
3、填空题 (10分)(1)同温同压下,两种气体A和B的体积之比为2:1,质量之比为8:5,则A与B的密度之比为?????????,摩尔质量之比为????????????。
(2)在标准状况下a. 6.72L CH4气体?? b.3.01×1023个HCl气体分子??? c.13.6g?? H2S气体? d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
①四种气体的物质的量????????????????,
②标准状况下四种气体的体积???????????????????,
③四种气体的质量??????????????????????????????。
参考答案:(10分)(1) 4:5 ; 4:5 (2)①? b>c>a
本题解析:考查物质的量的有关计算。
(1)根据阿伏加德罗定律可知,气体的体积之比是气体的物质的量之比,所以 ,解得
,解得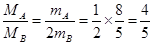 。又因
。又因
本题难度:一般
4、选择题 设NA为阿伏伽德罗常数的值,下列叙述正确的是???????????????????????????????(????)
A.60gSiO2含有的Si—O共价键数为2NA
B.常温常压下,1L1mol/L的亚硫酸钠溶液中的SO32-的个数为NA
C.标准状况下,11.2LSO3所含分子数为0.5NA
D.1.5 mol NO2与足量H2O反应,转移的电子数为NA
参考答案:D
本题解析:
试题分析:A.SiO2为四面体结构,一个硅原子形成4个硅氧键,60gSiO2为1mol含有的Si—O共价键数为4NA,A不正确;
B.SO32-会水解生成亚硫酸,存在水解平衡,故1L1mol/L的亚硫酸钠溶液中的SO32-的个数为不为NA,B不正确;
C.标准状况下,SO3是固体,不能使用标准状况下的气体摩尔体积计算,C不正确;
D.1.5 mol NO2与足量H2O反应,转移的电子数为NA,D正确,故选D。
点评:本题考查阿伏伽德罗常数,属于基础题,也是高考的常见考点。解
本题难度:一般
5、计算题 已知Mg能在CO2气体中燃烧(CO2+2Mg  ?2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
?2MgO+C)。若将6 g镁粉在下列不同条件下点燃。
求:(1)在足量CO2气体中,反应结束后所得固体的质量。
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为_______克。
参考答案:(1)11.5 g(2) 10
本题解析:
试题分析:(1)Mg和CO2反应的化学方程式为:CO2 + 2Mg  ?2MgO + C?n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5"
?2MgO + C?n(Mg)="6" g /24 g·mol-1="0.25" mol ,m(MgO)="0.25" mol×40 g·mol-1="10" g;m(C)="0.25" mol /2×12 g·mol-1="1.5"
本题难度:一般