微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 过量锌粉跟100mL6mol/L盐酸反应,在一定温度下,为加快反应速率但又不影响生成氢气的总量,可向反应混合物中加入适量的 [???? ]
A.铜粉
B.醋酸锌溶液
C.氯化铜固体
D.二氧化锰
参考答案:AC
本题解析:
本题难度:一般
2、填空题 室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
实验
编号
| I—的初始浓度
(mol·L-1)
| OCl—的初始浓度
(mol·L-1)
| OH—的初始浓度
(mol·L-1)
| 初始速率v
(mol·L-1· s-1)
|
1
| 2 × 10
参考答案:
本题解析:
本题难度:一般
3、实验题 (10分,每空2分)甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离平衡常数为5.4×10-2)
??????????????????????? ??????????? ??????????? ??????????????????????????????????????。 ??????????????????????????????????????。
设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(2)甲组:通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
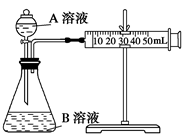
序号
| A溶液
| B溶液
| ①
| 2 mL 0.1 mol/L H2C2O4溶液
| 4 mL 0.01 mol/L KMnO4溶液
| ②
| 2 mL 0.2 mol/L H2C2O4溶液
| 4 mL 0.01 mol/L KMnO4溶液
| ③
| 2 mL 0.2 mol/L H2C2O4溶液
| 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4
该实验探究的是????????????对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是???????????????(用实验序号填空)。
(3)乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率的大小。
取两支试管各加入2 mL 0.1  mol/L mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究??????????????对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是????????????????????????????????????????????。 并振荡,记录溶液褪色所需时间。该实验目的是研究??????????????对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是????????????????????????????????????????????。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
4、填空题 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g) +H2O(g) H2(g) +CO2 H2(g) +CO2
(g)的平衡常数随温度的变化如下表

试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或 “吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率____(填“增大”、“减小” 或“不变”),容器内混合气体的压强____(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进 行的有____(选填字母)。
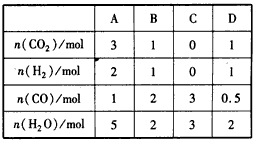
(4)830℃时,在2L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是_______。
参考答案:(1)放热
(2)增大;增大
(3)BC
本题解析:
本题难度:一般
5、选择题 在3L密闭容器中充入2molSO2和一定量O2,反应生成SO3气体,当进行到6min时,测得n(SO2)=0.4mol,若反应只进行到3min时,容器内n(SO2)为
A.小于1.2mol
B.0.8mol
C.大于0.8mol
D.小于0.8mol
参考答案:A
本题解析:本题考查浓度对化学反应速度的影响
密闭容器中进行的反应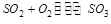 ,反应物 ,反应物 的浓度越高,反应的速度越快;随着反应的持续进行 的浓度越高,反应的速度越快;随着反应的持续进行
本题难度:一般
|
|