2.6
回答下列问题:
(1)该反应的平衡常数表达式K=__________,升高温度,化学平衡向__________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A c(CO2)=c(CO) B K不变 C 容器中的压强不变
D.v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温
度为_____;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol
CO、1.5 mol H2O,则此时反应朝______方向进行(填“正反应”、“逆反应”)。
参考答案:(9分)
(1)K= 本题解析: 本题解析:
试题分析:(1)根据化学方程式即化学平衡常数的定义可知,该反应的平衡常数K=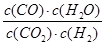 ;温度升高平衡常数增大,说明温度升高,平衡向正反应方向移动; ;温度升高平衡常数增大,说明温度升高,平衡向正反应方向移动;
(2)A二氧化碳与CO的浓度相等,不能说明平衡到达,错误;B、K不变,只能说明温度不变,不能说明平衡到达,错误;C、该反应是气体压强一直不变的可能反应,所以压强不变,不能说明达到平衡状态,错误;D、氢气的正反应始终等于二氧化碳的正反应速率,不能判断平衡状态的到达,错误;E、氢气的浓度保持不变的状态是平衡状态,正确,答案选E;
(3)c(CO2)·c(H2)=c(CO)·c(H2O),说明平衡常数K=1,此时的温度是850 ℃;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol CO、1.5 mol H2O,此时的浓度积=0.75×1.5/1×1.2<1,所以反应正向进行。
考点:考查平衡常数的计算与应用,平衡状态的判断
本题难度:困难
2、填空题 工业合成氨与制备硝酸一般可连续生产,流程如下
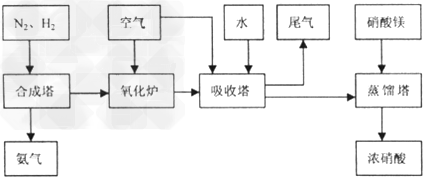
(1)工业生产时,制取氢气的一个反应为: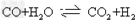 , ,
①t℃时,往l?L密闭容器中充入0.2?mol?CO和0.3?mol水蒸气,反应建立平衡后,体系中c(H2)=0.12?mol/L,该温度下此反应的平衡常数K=________;(请填数字不必带单位)
②保持温度不变,向上述平衡体系中再加入0.1?mol?CO,当反应重新建立平衡时,水蒸气的总转化率α(H2O)=__________。
(2)合成塔中发生反应为:N2(g)+3H2(g) 2NH3(g)下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______573K(填“>”、“<”或“=”)。在生产中,若要增大H2的转化率,在其他条件不变的情况下可以采取的措施为________(填字母)。 2NH3(g)下表为不同温度下该反应的平衡常数。由此可推知,表中T1_______573K(填“>”、“<”或“=”)。在生产中,若要增大H2的转化率,在其他条件不变的情况下可以采取的措施为________(填字母)。
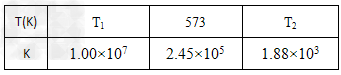
A.加入一定量H2???B.加入一定量N2????
C.将生成的气体NH3液化分离??D.升高温度
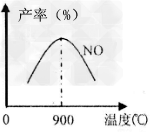
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:4NH3+5O2 4NO+6H2O????△H=-905kJ/mol,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因______________________。 4NO+6H2O????△H=-905kJ/mol,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因______________________。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___________________ 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是___________________
参考答案:(1)①1;②50%???????????
(2)&l
本题解析:
本题难度:一般
3、选择题 对可逆反应2A(s)+3B(g) C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( ) C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②
B.④
C.③
D.④⑤
参考答案:B
本题解析:A是固体,增加A的质量,反应速率和平衡都不变,①不正确。升高温度或增大压强,反应速率一定是增大的,②③不正确。增大B的浓度,v(正)>v(逆),平衡向正反应方向移动,④正确。催化剂只能改变反应速率,但不能影响平衡状态,转化率不变,⑤不正确,所以答案选B。
本题难度:一般
4、填空题 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
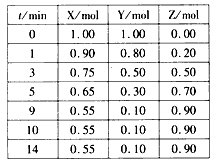
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是_________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率:_______________;
(4)该反应达到平衡时反应物X的转化率α等于__________________;
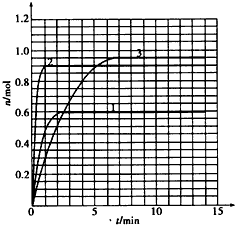
(5)如果该反应是放热反应。改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示),则曲线1、2、3所对应的实验条件改变分别是: l________,2________ ,3________。
参考答案:(1)![]() 本题解析: 本题解析:
本题难度:一般
5、填空题 可逆反应A(g)+2B(g)  2C(g) △H=-QkJ·mol-1 (Q>0)在一个密闭容 2C(g) △H=-QkJ·mol-1 (Q>0)在一个密闭容
器中进行,并在一定条件下达到平衡。若改变条件,将相应的变化结果(“增大”、“减
小”或“不变”)填入下列空格。
(1)保持温度和压强不变,加入不参与反应的稀有气体,A的转化率 。
v正 ,v逆
(2)保持温度和体积不变,加入不参与反应的稀有气体,A的转化率 。
v正 ,v逆
(3)若温度和体积不变,反应从A、B开始至平衡,在这个变化过程中,容器内气体的
密度 ,压强 。
参考答案:(1)减小 减
本题解析:
试题分析:可逆反应A(g)+2B(g)  2C(g) △H=-QkJ·mol-1 (Q>0),为放热反应,故(1)保持温度和压强不变,加入不参与反应的稀有气体,即相当于减小压强,所以反应向逆反应方向移动,故A的转化率减小,由于浓度较小,故正逆反应速率都较小;(2)保持温度和体积不变,加入不参与反应的稀有气体,虽然压强变大,但是反应物的浓度不变,故平衡不移动,故A的转化率不变,正逆反应速率也不变;(3)若温度和体积不变,反应从A、B开始至平衡,因为该反应为反应分子数减小的反应,所以反应后的压强变小,而因为体积不变,故容器内气体的密度不变。 2C(g) △H=-QkJ·mol-1 (Q>0),为放热反应,故(1)保持温度和压强不变,加入不参与反应的稀有气体,即相当于减小压强,所以反应向逆反应方向移动,故A的转化率减小,由于浓度较小,故正逆反应速率都较小;(2)保持温度和体积不变,加入不参与反应的稀有气体,虽然压强变大,但是反应物的浓度不变,故平衡不移动,故A的转化率不变,正逆反应速率也不变;(3)若温度和体积不变,反应从A、B开始至平衡,因为该反应为反应分子数减小的反应,所以反应后的压强变小,而因为体积不变,故容器内气体的密度不变。
考点:化学平衡的移动
点评:本题考查了化学平衡的移动,该考点是高考考查的重点和难点,本题侧重于考查学生的基础知识,该题比较容易。
本题难度:困难
|