微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 现有一可导热体积固定的密闭容器A,和一可导热容积可变的容器B.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2?N2O4;△H<0)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA______VB.(填“>”、“<”、“=”);若打开活塞K2,气球B将______(填:变大、变小、不变).
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将______(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将______,B中NO2的转化率将______(填:变大、变小、不变).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为______.
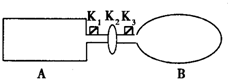
参考答案:(1)容器A中压强降低,容器B体压强不变,压强越大,反应速率
本题解析:
本题难度:一般
2、填空题 (14分)某温度时,将0.200mol的A气体充入2L抽空的密闭容器中,隔一定的时间对该容器内的物质进行分析,得到如下数据:
| 时间(S)浓度 | 0 | 20 | 40 | 60 | 80 | 100
c(A)mol?L-1
0.100
0.070
0.050
c3
a
b
c(B)mol?L-1
0.000
0.060
c2
0.120
0.120
0.120
试填空:
(1)该反应的化学方程式为______,表中c2______c3、a______b(填>、<、=),若在相同情况下最初向该容器充入的是B气体,要达到上述同样的平衡状态,B的起始浓度是______mol?L-1.
(2)在体积为l?L的密闭容器中,充入lmol?CO2和3mol?H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
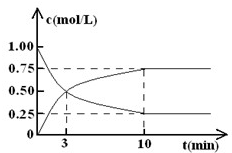
(I)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=______;
该反应的平衡常数k=______.
(II)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)?
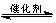
?CH3CH2OH(g)+3H2O(g)???25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
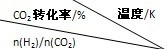
| 500 | 600 | 700 | 800
1.5
45
33
20
12
2.0
60
43
28
15
3.0
83
62
37
22
①温度升高,K值______(填“增大”、“减小”、或“不变”).
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”).
参考答案:(1)由表中数据可知A为反应物,B为生成物,20s时A的浓度
本题解析:
本题难度:一般
3、选择题 高温下,某反应达到平衡,平衡常数K= .已知恒容时升高温度,H2的浓度减小.下列说法正确的是( ) .已知恒容时升高温度,H2的浓度减小.下列说法正确的是( ) A.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2
B.该反应的△H>0
C.升高温度,正反应速率增大,逆反应速率减小
D.恒温恒容下,增大压强,H2的浓度一定减小
参考答案:B
本题解析:
本题难度:简单
4、填空题 钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取.该反应为:Na(l)+KCl(l)?NaCl(l)+K(g)-Q?该反应的平衡常数可表示为:K=C(K)?各物质的沸点与压强的关系见下表.
压强(kPa)
13.33
53.32
101.3
K的沸点(℃)
590
710
770
Na的沸点(℃)
700
830
890
KCl的沸点(℃)
1437
NaCl的沸点(℃)
1465
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为______,而反应的最高温度应低于______.
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是______.
(3)常压下,当反应温度升高至?900℃时,该反应的平衡常数可表示为:K=______.
参考答案:(1)在常压下金属钾转变为气态从反应混合物中分离,反应平衡体
本题解析:
本题难度:简单
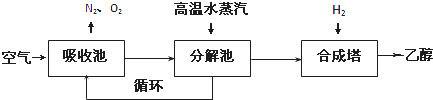
5、简答题 由碳的氧化物直接合成乙醇燃料已进入大规模生产.下图是由二氧化碳合成乙醇的技术流程:
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇.回答下列问题:
(1)写出吸收池中反应的离子方程式______.
(2)从分解池中循环使用的物质是______.
(3)工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)写出该反应的化学平衡常数表达式K=______.
(4)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数.则由CO制取CH3CH2OH相比由CO2制备CH3CH2OH的优点是______(写出一点即可);
(5)已知:一定条件下,2.0g乙醇完全燃烧生成液态水放出59.43kJ的热量,在该条件下:
①写出表示乙醇燃烧热的热化学方程式______.②若以乙醇作燃料,KOH作电解质,构成燃料电池,请写出负极的电极方程式:______.
(6)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如下表:
温度(K)
CO2转化率%
n(H2)/n(CO2) | 500 | 600 | 700 | 800
1.5
45
33
20
12
2.0
60
43
28
15
3.0
83
62
37
22
根据表中数据分析:
温度升高,该反应的平衡常数K值______(选填“增大”、“减小”或“不变”);
参考答案:(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化
本题解析:
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|