微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是( )
A.0.lmol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+)
B.等体积等pH的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少
C.将nmolH2(g)、nmolI2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者
D.某物质的溶液中由水电离出的c(H+)=1×10-amol?L-1,若a>7时,则该溶液的pH一定为14-a
参考答案:A、0.lmol/L醋酸钙溶液中,Ca2+浓度为0.1mol
本题解析:
本题难度:简单
2、填空题 (14分)(Ⅰ)甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
化学反应
| 平衡常数
| 温度℃
|
500
| 800
|
①2H2(g)+CO(g)  CH3OH(g) CH3OH(g)
| K1
| 2.5
| 0.15
|
②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g)
| K2
| 1.0
| 2.50
|
③3H2(g)+CO2(g)  CH3OH(g)+H2O (g) CH3OH(g)+H2O (g)
| K3
|
|
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正 V逆(填“>”、“=”或“<”)。
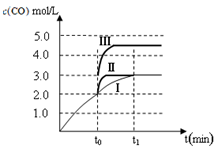
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
(Ⅱ)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为_______。
参考答案:(Ⅰ)(1)K1·K2(2分); >(2分)
本题解析:
试题分析:(Ⅰ)(1)反应①的平衡常数表达式K1=[CH3OH]/[CO][H2]2,反应②的平衡常数表达式K2="[CO]" [H2O]/[CO2][H2],反应③的平衡常数表达式K3=[CH3OH] [H2O]/[CO2][H2]3,则K3= K1·K2。500℃时反应③的平衡常数K3= K1·K2=2.5,在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, Q=(0.3×0.15)÷(0.8×0.1)=0.5625,Q<K,反应正向进行,则此时V正>V逆。(2)对于反应②:在t0时刻改变一个条件,曲线Ⅰ变为曲线Ⅱ,由图像可知平衡时c(CO)不变,说明平衡没有移动,但缩短了达平衡的时间,改变的条件为加入催化剂;当曲线Ⅰ变为曲线Ⅲ时,CO的平衡浓度由3.0mol/L迅速变为4.5 mol/L,反应在3 L容积可变的密闭容器中发生,且该反应两边气体物质的系数相等,则改变的条件为将容器的体积(快速)压缩至2L。(3)醋酸的电离方程式为CH3COOH  CH3COO-+H+,要计算醋酸的电离常数也就是求[CH3COOH]、[CH3COO-]和[H+],根据题给信息反应后剩余醋酸的浓度为(a-2b)/2mol/L,混合液中的电荷守恒式为2[Ba2+]+[H+]=[CH3COO-]+[OH-],又反应平衡时,反应平衡时,2c(Ba2+)= c(CH3COO-),得[CH3COO-]="b" mol/L,[H+]=[OH-]=10-7 mol/L,带入平衡常数表达式计算可得醋酸的电离常数为 CH3COO-+H+,要计算醋酸的电离常数也就是求[CH3COOH]、[CH3COO-]和[H+],根据题给信息反应后剩余醋酸的浓度为(a-2b)/2mol/L,混合液中的电荷守恒式为2[Ba2+]+[H+]=[CH3COO-]+[OH-],又反应平衡时,反应平衡时,2c(Ba2+)= c(CH3COO-),得[CH3COO-]="b" mol/L,[H+]=[OH-]=10-7 mol/L,带入平衡常数表达式计算可得醋酸的电离常数为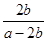 ×10-7。(Ⅱ)(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时二者反应生成草酸氢钠溶液,草酸氢钠(NaHC2O4)溶液显酸性,则草酸氢根的电离程度大于其水解程度,溶液中各种离子浓度的大小关系c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2)设25mL溶液中含xmol H2C2O4·2H2O 、ymol KHC2O4,根据酸碱中和滴定可以得出:2x+y=0.25×0.02,根据氧化还原反应判断,5C2O42———2MnO4—,可以得出:x+y=0.1×0.016×2.5,解得x=0.001mol,所以在250mL中 H2C2O4·2H2O的物质的量为0.01mol,质量为1.26g,质量分数为21%。 ×10-7。(Ⅱ)(1)常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时二者反应生成草酸氢钠溶液,草酸氢钠(NaHC2O4)溶液显酸性,则草酸氢根的电离程度大于其水解程度,溶液中各种离子浓度的大小关系c(Na+)> c(HC2O4-)> c(H+)> c(C2O42-) > c(OH-);(2)设25mL溶液中含xmol H2C2O4·2H2O 、ymol KHC2O4,根据酸碱中和滴定可以得出:2x+y=0.25×0.02,根据氧化还原反应判断,5C2O42———2MnO4—,可以得出:x+y=0.1×0.016×2.5,解得x=0.001mol,所以在250mL中 H2C2O4·2H2O的物质的量为0.01mol,质量为1.26g,质量分数为21%。
考点:考查化学反应速率和化学平衡,溶液中的离子反应及相关计算。
本题难度:困难
3、选择题 下列事实不能用勒夏特列原理解释的是( )
A.往氢硫酸溶液中加入碱,有利于S2-增多
B.经粉碎的黄铁矿燃烧得较快、较完全
C.实验室用排饱和食盐水的方法收集氯气
D.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率
参考答案:A.硫化氢中存在电离平衡,加入碱,平衡正向移动,有利于S2-
本题解析:
本题难度:一般
4、选择题 一定温度下,在固定容积的密闭容器中,有可逆反应mA(g)+nB(g)  pC(g)+qD(g), pC(g)+qD(g),
当m、n、p、q为任意正整数时,下列状态:
①体系的压强不再发生变化 ②体系的密度不再发生变化
③各组分的物质的量浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A):v(B):v(C):v(D)=m:n:p:q,
其中一定能说明反应已达到平衡的是( )
A. 只有③④ B. ②③④
C. ①②③④ D. ①②③④⑤
参考答案:A
本题解析:
试题分析:可逆反应mA(g)+nB(g)  pC(g)+qD(g),其反应前后的分子数并不能确定,故①体系的压强不再发生变化不一定能够说明该反应达到平衡,故①错误;该反应是在固定容积的密闭容器中进行,所以反应从头到尾都是密度不发生变化的,故②错误;各组分的物质的量浓度不再改变、各组分的质量分数不再改变则可以说明该反应达到平衡状态,故③④正确;反应速率v(A):v(B):v(C):v(D)=m:n:p:q,在反应的各个阶段都是这样的,不能用来判断反应达到平衡,故本题的答案选择A。 pC(g)+qD(g),其反应前后的分子数并不能确定,故①体系的压强不再发生变化不一定能够说明该反应达到平衡,故①错误;该反应是在固定容积的密闭容器中进行,所以反应从头到尾都是密度不发生变化的,故②错误;各组分的物质的量浓度不再改变、各组分的质量分数不再改变则可以说明该反应达到平衡状态,故③④正确;反应速率v(A):v(B):v(C):v(D)=m:n:p:q,在反应的各个阶段都是这样的,不能用来判断反应达到平衡,故本题的答案选择A。
考点:化学平衡的判断
点评:本题考查了化学平衡的判断,该考点是高考考查的重点和难点,本题要抓住该反应反应前后气体分子数并不能确定,本题难度中等。
本题难度:困难
5、选择题 对于某温度下平衡体系mA(g) + nB(g) pC(g) + qD(g) △H<0,下列说法不正确的是 pC(g) + qD(g) △H<0,下列说法不正确的是
A.若温度不变将容器容积扩大到原来的2倍,此时A的浓度变为原来的0.52倍,则m + n > p + q
B.向平衡体系中加入C、D,该反应的△H减小
C.若温度和容器体积不变,充入一定量的惰性气体,B的浓度不变
D.若平衡时,增加A的量,A的转化率下降,B的转化率增加
参考答案:B
本题解析:
试题分析:A、若温度不变将容器容积扩大到原来的2倍,若平衡不移动,则A的浓度变为原来的0.5倍,此时A的浓度变为原来的0.52倍,说明体积增大,压强减小,平衡逆向移动,则逆向是气体物质的量增大的方向,所以m+n>p+q,正确;B、反应热与物质的状态及方程式中反应物的系数有关,与实际反应的物质的量无关,所以该反应的△H不变,错误;C、若温度和容器体积不变,充入一定量的惰性气体,,反应体系中各物质的浓度均不变,所以平衡不移动,B的浓度不变,正确;D、对于多种反应物的反应,增加一种物质的量,会增大其他物质的转化率,而自身的转化率降低,所以平衡时,增加A的量,A的转化率下降,B的转化率增加,正确,答案选B。
考点:考查条件对平衡移动的影响
本题难度:一般
|