微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸化学式
| HF
| HClO
| H2CO3
|
电离平衡常数
| 6.8×10-4
| 4.7×10-8
| K1=4.3×10-7
K2=5.6×10-11
下列推断正确的是
A.常温下,同物质的量浓度NaClO与NaHCO3溶液,前者的pH较小
B.若某溶液中c(F—)=c(ClO—),往该溶液中滴入HCl,F-比ClO-更易结合H+
C.往饱和Na2CO3溶液中逐滴加入稀盐酸至过量,所得溶液中c(HCO3—)先增大后减小
D.同温下,等体积、等pH的HF和HClO分别与NaOH完全反应,消耗等量的NaOH
参考答案:C
本题解析:
试题分析:从电离平衡常数大小看出,酸性:HF > H2CO3 > HClO > HCO3-。由于H2CO3的酸性比HClO强,所以浓度相同时ClO-的水解程度比HCO3-大,故常温下,同物质的量浓度NaClO与NaHCO3溶液,前者的pH较大,A错;由于HClO的酸性比HF弱,所以ClO-更易结合H+生成弱电解质,B错;往饱和Na2CO3溶液中逐滴加入稀盐酸先发生H++CO32-=HCO3-,盐酸过量时发生:HCO3- +H+=CO2 ↑+H2O,C对;由于HClO的酸性比HF弱,等pH时HClO的浓度更大,与NaOH完全反应,消耗等量的NaOH体积不相等,D错。选C。
考点:弱电解质强弱的比较,盐类水解、离子浓度的比较。
本题难度:困难
2、选择题 对于CH3COOH、HCl、H2SO4三种溶液,下列判断正确的是
A.pH相同的三种溶液,物质的量浓度最小的是HCl
B.物质的量浓度相同的三种溶液,pH最小的是H2SO4
C.含溶质的物质的量相同的三种溶液与过量镁粉反应,CH3COOH产生的H2最多
D.相同pH、相同体积的三种溶液用NaOH溶液完全中和时,消耗NaOH溶液一样多
参考答案:B
本题解析:略
本题难度:一般
3、选择题
(1)在实验过程中水的电离程度的变化趋势是先_______后________;(填“增大”、“减小”或“不变”)
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。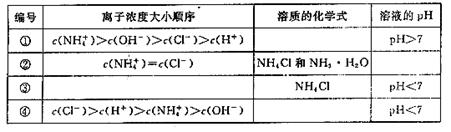
参考答案:(1) 增大?减小(2)①NH3·H2O和NH4Cl???②
本题解析:本题考查了电解质溶液中电解质的电离、水解和离子浓度问题。属于中等难度题。
  (1)由NH3·H2O??? NH (1)由NH3·H2O??? NH
本题难度:一般
4、选择题 下列事实能说明亚硝酸是弱电解质的是[???? ]
①亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗 ③HNO2溶液不与Na2SO4溶液反应
④0.1mol·L-1 HNO2溶液的PH=2.1
A、①②③
B、②③④
C、①④
D、①②④
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列实验能达到预期目的的是?????(??)
编号
| 实验内容
| 实验目的
| A
| 室温下,用pH试纸分别测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
| 比较HClO和CH3COOH的酸性强弱
| B
| 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅
| 证明Na2CO3溶液中存在水解平衡
| C
| 向10mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/LFeCl3溶液,又生成红褐色沉淀
| 证明在相同温度下的Ksp:
Mg(OH)2 >Fe(OH)3
| D
| 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大
| 证明非金属性S>C
参考答案:B
本题解析:
试题分析:A.NaOH是强碱,HClO、CH3COOH是弱酸,因此它们产生的盐都是强碱弱酸盐,水解使溶液显碱性。但是NaClO溶液水解产生的HClO有漂白性,因此不能通过用PH试纸测定溶液的pH比 较HClO和CH3COOH的酸性强弱。错误。B. Na2CO3是强碱弱酸盐,水解消耗水电离产生的H+而使溶液显碱性,因此向该盐的水溶液中滴加酚酞变为红色。若向含有酚酞的Na2CO3溶液中加入少量BaC12固体,会发生反应:CO32-+Ba2+=BaCO3↓,使CO32-的水解平衡逆向移动。水解程度减小,所
本题难度:一般
|
|