微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 萃取碘水中的碘,可用的萃取剂是①四氯化碳?②酒精?③苯(???)
A.只有①
B.①和②
C.①和③
D.①②③
参考答案:C
本题解析:酒精和水互溶,不能作萃取剂,四氯化碳和苯均不溶于水,而碘又易溶在有机溶剂中,可用作萃取剂,所以答案选C
本题难度:简单
2、选择题 下列各组溶液中,不用任何其他试剂就能鉴别的是( )
A.Na2SO4 H2SO4 AlCl3 BaCl2
B.HCl NaOH K2SO4 NaHCO3
C.AlCl3 KHCO3 NaCl Na2SO4
D.NaOH FeCl3 MgCl2 K2SO4
参考答案:D
本题解析:
试题分析:不用其他试剂,就能将组内物质鉴别出来,首先需考虑物质的颜色,然后将鉴别出来的物质与其他物质混合,根据现象的不同加以鉴别,若物质都是没有颜色,则让溶液之间两两混合,根据不同的实验现象加以鉴别。
A中的氯化钡能与硫酸、碳酸钠均产生沉淀,故能与两种物质产生沉淀的是氯化钡,不与氯化钡反应的物质为氯化铝,但硫酸钠和硫酸不能鉴别,故A不符合题意;B中四种物质两两混合,只能依据是否有气体生成分为两组,不加其他物质不能鉴别,故B不符合题意;C中四种物质两两混合,只能依据是否有气体和白色沉淀生成分为两组,不加其他物质不能鉴别,故C不符合题意;D中根据物质颜色,首先鉴别出氯化铁,然后将氯化铁与其他三种物质混合,能产生红棕色沉淀的是氢氧化钠。向其他两种物质中滴加氢氧化钠,能产生白色沉淀的是氯化镁,无现象的是氯酸钾,故D正确,答案选D。
点评:该题综合性强,对学生的思维能力要求高,学生不要得分。在做物质的鉴别题时,主要分为两类:一是类选项中的有带色的离子,首先鉴别,然后再区别其他的物质,另一类就是需要鉴别物质都是无色的,就需要互滴进行鉴别,不管哪种,在鉴别时每组出现的现象不能完全相同。
本题难度:一般
3、选择题 某化学兴趣小组设计以下实验方案,可从样品中提取粗产品:

下列说法错误的是
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
参考答案:C
本题解析:
试题分析:A、除去不溶性物质采用过滤的方法,正确;B、步骤(2)分离水层溶液和有机层溶液采用分液的方法,需用到分液漏斗,正确;C、步骤(3)由水层溶液析出固体采用蒸发的方法,需要用到蒸发皿,错误;D、由有机层溶液分离出甲苯应采用蒸馏的方法,正确。
本题难度:一般
4、实验题 某化学课外活动小组将氯化钠固体中混有的硫酸钠、碳酸氢铵杂质除去并得到氯化钠溶液,设计了如下方案:
 ?
?
④加热
煮沸
?
过滤
?
①加热
?
?
⑴操作①的目的是???????????????????。
⑵操作②是否可改为加硝酸钡溶液?为什么?
⑶进行操作②后,如何判断SO42-已除尽,方法是???????。
⑷操作③的目的是???????,为什么不先过滤后加碳酸钠溶液?理由是???????????????????。
⑸操作④的目的是???????????????????
参考答案:除去NH4HCO3,NH4HCO3 本题解析:本题能力层次为D。NH4HCO3受热分解,用加热方法可以除去;用BaCl2除Na2SO4,稍过量的Ba2+用Na2CO3除去,然后再用盐酸除去稍过量CO32-。 本题解析:本题能力层次为D。NH4HCO3受热分解,用加热方法可以除去;用BaCl2除Na2SO4,稍过量的Ba2+用Na2CO3除去,然后再用盐酸除去稍过量CO32-。
进行实验方案设计时,首先要了解该实验的目标是什么;其次要清楚每一个实验步骤的目的是什么,理解它的化学原理,知道需要哪些化学仪器和药品,它们的作用是什么,如何使用;还要考虑加入试剂的先后顺序、试剂的用量,以及试剂过量后如何处理;以及实验操作应该注意什么问题,操作步骤是否能够简化等。
本题难度:简单
5、简答题 (2014届河北省唐山市高三4月第二次模拟理综化学试卷)
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子
| Na+ Al3+???Fe3+ Cu2+、 Ba2+
| 阴离子
| OH- Cl- CO32- NO3- SO4-
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A?????????????;C?????????????。
(2)写出步骤②中发生反应的化学方程式???????????????????????????????????。
(3)D溶液中滴入石蕊试液,现象是??????????????????????????????????????????,
原因是????????????????????????????????????????????(用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是???????????????mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为????????????????????????????????。
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。
 ’ ’
参考答案:(1)CuSO4? Ba(OH)2(各1分)
(2)2
本题解析:由①知,A、C反应产生的沉淀中应是氢氧化铜和硫酸钡沉淀;则A、C是CuSO4、Ba(OH)2中的一种;由②知,B、E只能是盐类,双水解产生气体和沉淀,其中含有Fe3+、CO32-,且其中必有Na2CO3;由③知C为强碱,所以C是Ba(OH)2,A是CuSO4;D为铝盐;由②④知,E为Na2CO3;由⑤知D中有NO3-,所以D为Al(NO3)3,则B只能为FeCl3。
(1)A、C的化学式为:CuSO4、Ba(OH)2
(2)步骤②是Fe3+、CO32-的双水解反应,化学方程式为
2FeCl3+3Na2CO3+3H2O=2Fe(OH)3↓+3CO2↑+6NaCl;
(3)Al(NO3)3溶液由于Al3+水解而是溶液显酸性,所以加入石蕊试液,溶液变红色,离子方程式为Al3++3H2O Al(OH)3+3H+ Al(OH)3+3H+
(4)根据Cu与稀硝酸反应的离子方程式3Cu+8H++2N3-=3Cu2++2NO↑+4H2O,得3Cu~8H+,38.4 g Cu的物质的量为0.6mol,所以需要硫酸的物质的量是0.8,其体积为500mL;
(5)由题意知n(CO2)=0.5mol,n(Na2CO3)=1.5mol,所以二者反应后溶液中有1mol的NaHO3,1mol的Na2CO3,
Na2CO3水解程度大于NaHO3水解程度,所以溶液中离子浓度由小到大的顺序为c(H+)<c(OH-)<c(CO32-)<c(HCO3-)<c(Na+)(2分)
(6)阳极先是Cl-放电,溶液中共有0.3mol Cl-,根据2 Cl- +2 e-= Cl2↑,得转移电子0.3mol时产生气体标准状况下的体积是3.36L;然后是氢氧根离子放电,4OH--4 e-=O2↑+2H+,每转移0.1mol电子就生成0.56L的气体,所以图像如下:
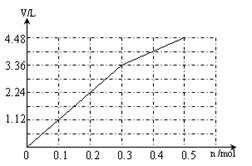
本题难度:一般
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|