微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关环境、健康、发展的叙述中不正确的是
A.煤的气化、液化可减少SO2和烟尘对大气造成的污染
B.人体需要的二十多种氨基酸都可以通过人体自身合成
C.硫酸钡可用于钡餐透视
D.对二甲苯(Paraxylene,简称PX)是一种重要的有机化工原料,也是一种易燃化学品
参考答案:B
本题解析:分析:A、煤燃烧产生的空气污染物主要有SO2、NO2、CO及烟尘等.
B、人体需要的氨基酸与二十多种,其中有几种是人体自身不能合成的.
C、硫酸钡不和盐酸反应所以能用于钡餐透视.
D、有机物大部分易燃烧,对二甲苯是一种重要的有机化工原料,也是一种易燃化学品.
解答:A、煤的气化是将其转化为可燃性气体的过程,煤的液化是使煤和氢气作用生成液体燃料,所以煤的气化、液化可减少SO2和烟尘对大气造成的污染,故A正确.
B、人体需要的氨基酸与二十多种,其中有几种是人体自身不能合成的,必须由食物获得,称为必需氨基酸,故B错误.
C、硫酸钡和盐酸不反应,所以能用于钡餐透视,碳酸钡能和盐酸反应生成可溶性的钡盐,所以碳酸钡不能用于钡餐透视,故C正确.
D、对二甲苯属于低毒有机物,是一种密度比水小,不溶于水,易挥发的易燃液体,对呼吸系统及神经中枢有一定刺激作用,故D正确.
故选B.
点评:本题考查了元素化合物的有关知识,难度不大,明确人体需要的氨基酸与二十多种,其中有几种是人体自身不能合成的.
本题难度:一般
2、选择题 把一瓶不饱和的烧碱溶液分成两等份,保持温度不变,向两份溶液中分别加入一定量的Na2O2、Na2O,使溶液恰好饱和,下列不合理的是
A.加入的Na2O2?和Na2O的质量相等
B.加入的Na2O2?和Na2O的物质的量相等
C.加入的Na2O2?和Na2O的质量之比为78:62
D.所得两份饱和溶液中溶质的物质的量相同
参考答案:A
本题解析:分析:发生反应2Na2O2+2H2O═4NaOH+O2↑,Na2O+H2O═2NaOH,由方程式可知,相同物质的量的Na2O2和Na2O的消耗相同物质的量的水,生成相同物质的量的NaOH,保持温度不变,使溶液恰好饱和,故加入的Na2O2、Na2O的物质的量相等,据此结合选项分析解答.
解答:发生反应2Na2O2+2H2O═4NaOH+O2↑,Na2O+H2O═2NaOH,由方程式可知,相同物质的量的Na2O2和Na2O的消耗相同物质的量的水,生成相同物质的量的NaOH,保持温度不变,使溶液恰好饱和,故加入的Na2O2、Na2O的物质的量相等,
A、由上述分析可知,加入的Na2O2、Na2O的物质的量相等,二者摩尔质量不相等,故加入质量不相等,故A错误;
B、由上述分析可知,加入的Na2O2、Na2O的物质的量相等,故B正确;
C、加入的Na2O2、Na2O的物质的量相等,故加入Na2O2、Na2O的质量之比等于摩尔质量之比为78g/mol:62g/mol=78:62,故C正确;
D、加入加入的Na2O2、Na2O的物质的量相等,生成相同物质的量的NaOH,所得两份饱和溶液浓中氢氧化钠的物质的量相同,故D正确;
故选A.
点评:本题考查钠的重要化合物、化学计算等,难度中等,关键是根据方程式判断两反应中消耗的水以及生成氢氧化钠的量的关系.
本题难度:一般
3、选择题 下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是
A.在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多
B.同价态的阳离子,甲比乙的氧化性强
C.甲能跟稀盐酸反应放出氢气而乙不能
D.在常温下甲能与浓硫酸反应放出气体而乙不能
参考答案:C
本题解析:分析:比较金属的活泼性,可根据金属与酸反应的剧烈程度、置换反应,对应阳离子的氧化性强弱等角度解答.
解答:A.比较金属的活泼性应根据失去电子的难易程度,不能根据金属失去电子的多少判断,故A错误;
B.价态的阳离子,甲比乙的氧化性强,说明乙比甲活泼,故B错误;
C.甲能跟稀盐酸反应放出氢气而乙不能,说明甲金属活动性在H之前,而乙在H之后,可说明甲比乙活泼,故C正确;
D.在常温下甲能与浓硫酸反应放出气体而乙不能,如乙发生钝化反应,则不能比较金属的活泼性,故D错误.
故选C.
点评:本题考查金属活动性的比较,题目难度不大,注意比较金属活动性的角度,易错点为D,注意铁、铝与浓硫酸发生钝化反应的性质.
本题难度:一般
4、选择题 下列反应中,不属于氧化还原反应的是
A.2H2O2?2H2O+O2↑
B.NH4ClNH3↑+HCl↑
参考答案:B
本题解析:分析:在化学反应中有元素化合价升降就是氧化还原反应,即有电子转移的就是氧化还原反应,据此分析判断.
解答:A.该反应中氧元素的化合价有升高的有降低的,所以该反应是氧化还原反应,故A不选;
B.该反应中,反应前后各元素的化合价都不发生变化,所以不是氧化还原反应,故B选;
故选B.
点评:本题考查了氧化还原反应的判断,根据反应前后各元素的化合价是否变化来分析判断即可,难度不大.
本题难度:一般
5、选择题 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KN03→K20+5Na20+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成42.0?L?N2(标准状况)
B.有0.250?mol?KN03被氧化
C.转移电子的物质的量为1.25?mol
D.被氧化的N原子的物质的量为3.75?mol
参考答案:C
本题解析:分析:10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为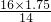 =2mol,以此来解答.
=2mol,以此来解答.
解答:10NaN3+2KN03→K20+5Na20+16N2↑中,N元素由+5价降低为0,反应中共转移10电子,若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为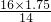 =2mol,
=2mol,
A.生成标况下氮气的体积为2mol×22.4L/mol=44.8L,故A错误;
B.由反应可知,被还原的硝酸钾的物质的量为 =0.25mol,故B错误;
=0.25mol,故B错误;
C.转移电子的物质的量为0.25mol×(5-0)=1.25mol,故C正确;
D.转移2mol电子被氧化的N原子为30mol,则转移1.25mol电子被氧化的N原子的物质的量为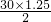 =18.75mol,故D错误;
=18.75mol,故D错误;
故选C.
点评:本题以信息的形式考查氧化还原反应,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大,注意将N3-作为整体来分析是解答的难点.
本题难度:简单