微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g)
NH3(g)+HI(g)
②2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5?mol/L,c(HI)=4?mol/L,则此温度下反应①的平衡常数为 [???? ]
A.9
B.16
C.20
D.25
参考答案:C
本题解析:
本题难度:一般
2、选择题 某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g) H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度
B.加入催化剂
C.再加入n molCO和n molH2O
D.再加入2n molCO2和2n molH2
参考答案:D
本题解析:
试题分析:该反应为反应前后气体的体积相等,压强不影响化学平衡移动。A、升高温度,平衡向正反应方向移动,但反应物不可能完全转化为生成物,所以氢气的物质的量浓度不可能增大1倍,故A错误;B、催化剂只是改变反应速率,不影响转化率,故B错误;C、再通入nmolCO2和nmolH2,平衡向逆反应方向移动,有部分氢气减少,所以氢气的物质的量浓度不可能是增大1倍,故C错误;D、再通入2nmol CO和2nmolH2O(g),平衡向正反应方向移动,当再次达到平衡状态时,氢气的物质的量浓度能增大1倍,故D正确,故答案选D。
本题难度:一般
3、计算题 在127℃和1.0×105Pa时,向某容器中放入18.4gN2O4使之发生反应N2O4 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
参考答案:(1)N2O4的分解率为50%;
(2)平衡时混合气体
本题解析:依题意nN2O4=(18.4g)/92g/mol=0.2mol
平衡混合气密度比原来减少1/3
∴(n起始/n平衡)=(ρ平衡/ρ起始)
=(2/3/1)=(2/3)
则有:n平衡=(3/2)n起始=(3/2)×0.2mol=0.3mol
(1)设N4O4分解率为x,则有:
N2O4 2NO2??Δn
2NO2??Δn
1??????2????1
0.2xmol?????(0.3mol-0.2mol)
解得?x=(0.1mol/0.2mol)=0.5=50%
(2)m总=18.4g
n总=0.3mol
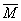 =(m总/n总)=(18.4/0.3)=61.33
=(m总/n总)=(18.4/0.3)=61.33
本题难度:简单
4、填空题 在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
ΔH<0,其化学平衡常数K与温度T的关系如下表: