微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 下图所示的装置
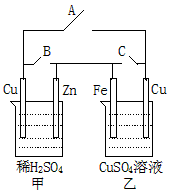
(1)当A键断开,B、C两键闭合时,甲为__________池,乙为__________池。甲池中各电极反应式为
________________、__________________。
(2)将乙中两极都换成石墨,硫酸铜溶液换成稀硫酸。断开B、C两键,闭合A键,甲为__________池,乙为__________池。当甲中锌减轻时,乙中共放出气体(标准状况)_______________ml。
参考答案:(1)原电;电解;Zn→Zn2++2e-;2H++2e-→
本题解析:
本题难度:一般
2、选择题 按下图所示装置做实验,若x轴表示流入阴极的电子的物质的量,则y轴可表示?
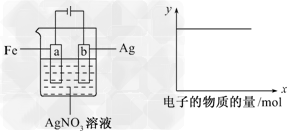 [???? ]
[???? ]
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的pH
A.①③??
B.③④
C.①②④??
D.①②⑤
参考答案:D
本题解析:
本题难度:一般
3、选择题 下表为部分短周期元素的原子半径及主要化合价。下列说法正确的是
元素代号
| L
| M
| Q
| R
| T
|
原子半径/nm
| 0.186
| 0.143
| 0.104
| 0.075
| 0.066
|
主要化合价
| +1
| +3
| +6、-2
| +5、-3
| -2
A.气态氢化物的稳定性:R>T
B.工业上电解MCl3溶液制备单质M
C.化合物L2T与QT2所含化学键类型相同
D.L与Q的最高价氧化物对应水化物均能与M(OH)3反应
参考答案:D
本题解析:
试题分析:由图中已知条件可得,L、M、Q为第三周期元素,R、T为第二周期元素。A、R、T两种元素处于同周期,非金属性依次增强,气态氰化物的稳定性依次增强,错误;B、由已知条件可知,M为金属铝,工业上用电解熔融Al2O3的方法制备单质铝,错误;C、化合物L2T为Na2O,QT2为SO2,所含化学键类型不同,错误;D、 L与Q的最高价氧化物对应水化物分别为氢氧化钠和硫酸,都可以和Al(OH)3反应,正确;故本题选择D。
考点:元素周期律的应用
本题难度:困难
4、填空题 碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为 ,可能发生副反应有 。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为 。
(3)向75 mL 4 mol?L-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。①写出该反应的离子方程式: 。(只用一个离子方程式表示)
②该吸收溶液中离子浓度大小排序为 。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1=—571.6kJ?mol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJ?mol-1
③ CO(g)+2H2(g) CH3OH(g) △H3 = —90.8kJ?mol-1 CH3OH(g) △H3 = —90.8kJ?mol-1
计算甲醇蒸气的燃烧热 = 。 = 。
(5)某温度下,发生可逆反应:CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g) 
①向某容器中充入1.0 molH2和1.0 molCO2(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
| 0
| 5 min
| 10 min
| 15 min
| 20 min
| 25 min
| I(800℃)
| 1.0
| 0.80
| 0.70
| 0.65
| 0.50
| 0.50
| II(800℃)
| 1.0
| 0.7
| 0.60
| 0.50
| 0.50
| 0.50
相对实验I,实验II可能改变的条件可能是 ,该温度下,平衡常数= 。
②若开始向绝热容器中投入一定量二氧化碳、氢气在一定条件下发生上述可逆反应。
下列图像正确且说明可逆反应达到平衡状态的是 。(填序号)
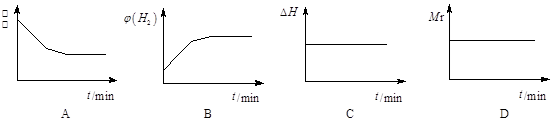
参考答案:(11分)
(1)2O2---4e-=O2↑(1分)
本题解析:
试题分析:(1)以石墨为阳极,电解氧化铝冶炼铝,所以阳极是O2-发生氧化反应,反应式为2O2---4e-=O2↑;因为用石墨作阳极,所以可能发生的副反应是C与生成的氧气发生反应生成二氧化碳或一氧化碳,C+O2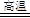 CO2(或2C+O2 CO2(或2C+O2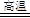 2CO); 2CO);
(2)一氧化碳和空气在酸性介质中构成燃料电池,则CO在该反应中作还原剂,发生氧化反应,结合电解质溶液,所以负极的电极反应式为CO-2e-+H2O=CO2+2H+;
(3)①4480mL的二氧化碳气体的物质的量是0.2mol,75 mL 4 mol?L-1KOH溶液中KOH的物质的量是0.3mol,所以该反应中有0.1mol碳酸钾和0.1mo碳酸氢钾,故离子方程式为2CO2+3OH--=CO32--+HCO3--+H2O;
②该吸收溶液为等浓度的碳酸钾和碳酸氢钾的混合液,溶液呈碱性,其中碳酸根离子的水解程度大于碳酸氢根离子的水解程度,所以混合液中离子浓度大小排序为c(K++)>c(HCO3--)>c(CO32--)>c(OH--)>c(H++);
(4)根据盖斯定律可得甲醇蒸气的燃烧热 =①+②/2-③=△H1+△H2 /2-△H3 =-763.8 kJ?mol-1; =①+②/2-③=△H1+△H2 /2-△H3 =-763.8 kJ?mol-1;
(5)①该反应是反应前后气体的物质的量不变的可逆反应,根据表中数据可知,实验II与实验I达到的平衡状态相同,但缩短了反应时间,说明反应速率加快,所以可能改变的条件是使用了催化剂、或者增大压强(缩小容器的体积);该温度下,平衡时各气体的物质的量浓度均相同,所以平衡常数为1;
②A、在绝热的容器中,加入一定量二氧化碳、氢气,反应逆向进行,逆向为放热反应,因为该容器绝热,使体系温度升高,则反应又正向进行,而正向是吸热反应,所以开始的温度最高后逐渐降低,达平衡时不再下降,正确;B、反应逆向进行,氢气的浓度逐渐减小直至不变,错误;C、对于该反应而言,反应放热,所以△H逐渐增大,达平衡时不再增大,错误;D、对于该反应而言,混合气体的相对分子质量始终不变,不能作为平衡状态的标志,错误,答案选A。
考点:考查电解质溶液、电化学反应原理、热化学的知识的应用
本题难度:一般
5、选择题 电极电解物质的量浓度相同的CuSO4和KCl的混合溶液一段时间后,测得溶液的pH<7。电解产物一定有下列物质:①Cl2②O2③Cu ④H2⑤KOH中的:( )??????
A.①③
B.①②③
C.①②③④
D.①②④⑤
参考答案:B
本题解析:在阳极上,2Cl--2e-=Cl2↑,然后4OH--=2H2O+O2↑;阴极上发生,Cu2++2e-=Cu;2H++2e-=H2↑;因溶液呈酸性,故阳极上生成氯气和氧气,阴极上生成铜。
本题难度:一般
|
|