微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
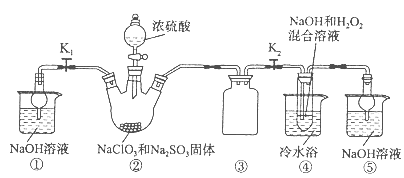
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:????????????????????。
(2)装置②中产生ClO2的化学方程式为 ????????????????????????????????。
装置④中发生反应的离子方程式为??????????????????????????????????。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②?????;③?????;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。

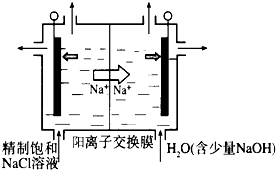
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 ??????????????。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为???mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是?????;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为??????????。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为????????。
2、选择题 通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银)
3、填空题 (11分)右图所示为相互串联的甲、乙两电解池,试回答:
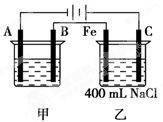
⑴若甲池利用电解原理在铁上镀银,则A电极材料是________,电极反应式是________________,B是_______极,应选用的电解质溶液是________?????;
⑵乙池中若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____??色,
C极附近呈_______色;
⑶若甲池阴极增重43.2 g,则乙池中阳极上放出的气体在标况下的体积是________mL;
⑷若乙池中剩余溶液仍为400 mL,则电解后所得NaOH溶液的物质的量浓度为________mol/L,pH等于
________。
4、实验题 某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)====CuSO4+H2↑。
(1)请在方框内画出能够实现这一反应的实验装置图。
?
(2)某同学在做铜与稀硫酸的上述反应实验时,看到碳棒和铜棒都有气泡产生,但铜棒没有被腐蚀。请你分析其原因___________________,此时的电池反应为____________________。
5、简答题 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是______(填序号).
A.只有还原性B.还原性和酸性C.只有氧化性D.氧化性和酸性
②若上述反应中产生0.1molClO2,则转移电子的物质的量为______mol.
(2)目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:______.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为______mol;用平衡移动原理解释阴极区pH增大的原因______.
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-amg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为______;处理100m3这种污水,至少需要ClO2______mol.
|