微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:


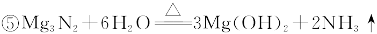
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。

回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是________________________________________________________________________________
_______________________________________________________________________________。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)______________________________。
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响? __________,原因是_____________________________________________________________________________。
(4)请设计一个实验,验证产物是氮化镁:________________________________________
_______________________________________________________________________________。
参考答案:(1)B 目的是除气流中的水蒸气,避免反应④发生;D 目的是
本题解析:(1)因Mg能与O2、CO2、H2O发生反应,应除去空气中的H2O、O2、CO2,用B来除去空气中的水蒸气,用D来除去空气中的CO2,用F来除去空气中的O2。
(2)除去空气中的H2O、O2、CO2的顺序应先除CO2再除去水蒸气,最后除去O2。
(3)如果同时点燃A、F装置的酒精灯,A中硬质玻璃管中空气没有排尽,这时Mg会与H2O、CO2、O2等反应,生成物会不纯。
(4)由于Mg3N2与水能发生水解反应,生成Mg(OH)2和NH3,因此可以用湿润的红色石蕊试纸来检验是否产生NH3即可验证有无Mg3N2生成。
本题难度:简单
2、实验题 课题式课堂教学是研究性学习的一种方式,其基本教学模式为:

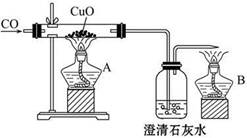
如图甲是关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段,甲同学设计的证明CO具有还原性的实验装置。
甲
(1)实验时应先点燃_____________(填“A”或“B”)处的酒精灯。
(2)硬质玻璃管中反应的化学方程式为__________________________________。
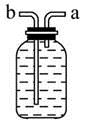
(3)乙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。如图乙是他设计的贮气瓶,尾气应从__________(填“a”或“b”)口通入(其他装置略)。
乙
(4)丙同学质疑:CO能否使澄清石灰水变浑浊?因此,他设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应,试对此作出评价。你认为丙的设计是否有必要?____________,理由是________________。
(5)如果开始时通入的是CO和CO2的混合气体,则应如何设计才能达到实验目的?_________________________________________________。
参考答案:(1)B???? (2)CuO+CO 本题解析:(1)CO为可燃性有毒气体,由于先通CO排空气,故应先点燃B处的酒精灯。
本题解析:(1)CO为可燃性有毒气体,由于先通CO排空气,故应先点燃B处的酒精灯。
(2)CO能还原CuO生成CO2和Cu。
(3)贮气瓶应从a口进气,水从b口排出。
(4)由于整个设计过程中要先通CO排出装置中空气,故CO已经通过了澄清石灰水,故没必要再排除CO的干扰。
(5)混合气体应先除去CO2再进入装置。
本题难度:一般
3、选择题 下列气体不能用排水集气法收集的是(??? )
A.NO
B.NH3
C.O2
D.CO
参考答案:B
本题解析:不能用排水法收集气体说明该气体易溶于水或能与水反应;
A,NO难溶于水且与水不反应;B氨气极易溶于水;C氧气难溶于水且与水不反应;D为CO也不水反应且难溶于水;
本题难度:简单
4、实验题 红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。
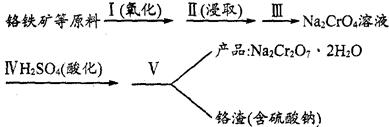
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A.升高温度
B.将原料粉碎
C.增加纯碱的用量
D.通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程