微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 主要用于煤矿井下急救。某兴趣小组拟选用如下装置制备超氧化钾(部分夹持仪器已略去)。
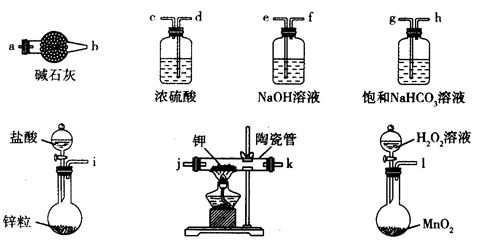
请回答下列问题:
(1)请选择必要的装置,按气流方向的连接顺序为_____________(填仪器接口的字母)。
(2)请根据完整的实验装置,完成下列实验步骤:①_____________________;②装入药品,打开分液漏斗活塞;③持续通入气体一段时间后,点燃酒精灯进行反应;④反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;⑤拆除装置,取出产物。
(3)数据记录如下:

根据数据计算可得实验式KOx,则x=____________________。
(4)超氧化钾可吸收二氧化碳,并生成氧气,因此可以作为飞船、潜艇等密闭系统的氧气再生剂。写出超氧化钾与二氧化碳反应的化学方程式:__________________________。与过氧化钠相比,其优点是______________________________。
参考答案:(1)lefdejka(jk可互换) (2分)
(2)
本题解析:
试题分析:(1)根据超氧化钾(KO2),容易与空气中的水、二氧化碳等发生反应,因此制备的过程中一定要把装置所含的水和二氧化碳除去,进入到陶瓷管中的气体应先经过氢氧化钠溶液除二氧化碳,再经过浓硫酸干燥,陶瓷管后面也要接一个装有碱石灰的干燥管,防空气中的水和二氧化碳与超氧化钾接触,故顺序为:lefdejka(jk可互换);(2) 第一步应为检查装置的气密性;(3)钾的物质的量为:(15.19-14.80)/39=0.01mol,氧的物质的量=(15.47-5.19)/16=0.175mol,所以X=0.175mol/0.01mol=1.75;(4)过氧化钠与CO2反应的方程式为2Na2O2+2CO2=2NaCO3+O2,KO2与CO2反应的方程式为4KO2+2CO2=2K2CO3+3O2,故其优点是相同质量的过氧化钠和超氧化钾相比,朝氧化钾释放的氧气多。
本题难度:一般
2、实验题 (14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:

已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:

⑴酸溶时,为了提高浸取率可采取的措施有????????????????。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式:?????????????????????????????。
⑶加入试剂②的目的是调节pH至a,a的范围是??????????;
为避免引入杂质离子,试剂②可选用??????????????。
A.氨水
B.氧化铜
C.氢氧化铜
D.氢氧化钠
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是:??????????????????????????????????。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,沉降后废水中Cu2+浓度为????????????????mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:??????????????????????????????。
参考答案:(14分)
⑴粉碎孔雀石或适当升高温度或搅拌或适当提高
本题解析:
试题分析:⑴酸溶时,为了提高浸取率可采取的措施有粉碎孔雀石或适当升高温度或搅拌或适当提高酸的浓度。
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,使亚铁转化为三价铁,通入Cl2发生反应的离子方程式:2Fe2++Cl2 = 2Fe3++ 2Cl-。
⑶加入试剂②的目的是调节pH至a,a的范围是3.7~5.4保证铁离子沉淀完全;
为避免引入杂质离子,试剂②可选用:氧化铜?;氢氧化铜 。
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是:抑制CuCl2 水解。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,C(OH-)=1×10-6所以沉降后废水中Cu2+浓度=Ksp[Cu(OH)2]/C2(OH-)=5.6×10-8mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。制备CuCl的离子方程式:2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++SO42-。
2CuCl↓+4H++SO42-。
点评:此题综合性较强,能够考查学生把所学知识运用到实际问题的能力。
本题难度:一般
3、实验题 (6分)实验室配制500ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末???????????????g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、???????????????????。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是?????????????。
A.加水定容时超过刻度线,又吸出少量水至刻度线;