微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)某化学研究性小组同学提出回收含铜电缆废料中提取铜的两种方案,并向老师咨询,老师就以下几个方面与同学们展开讨论:
方案甲:

(1)两个方案哪个符合当前生产的绿色理念,为什么?
??????????????????????????????????????????????????????????????????.
(2)写出方案甲中的②③步骤与铜有关的离子反应的离子方程式。
??????????????????????? ??????__________________ _?????? __________
??????__________________ _?????? __________
??????????????????????????????? _________________?????? _________。
(3)老师建议,无论是甲还是乙的方案,在“加铁屑”这一步时,应该加入略过量的铁屑,目的是:???????????????????????????????????。
(4)老师请同学们用化学方法检验红色粉末中是否含有过量的铁屑。请你填写下列表格写出实验操作、预期实验现象、结论及操作(②中相关的离子方程式)。
序号
| 实验操作
| 实验现象
| 结论及离子方程式
|
①
| 取适量的样品于试管内
| ——
| ——
|
②
| 用滴管滴入足量硫酸溶液,并充分振荡试管
| ?
| ?
|
③
| ?
| 溶液先黄色,滴入KSCN溶液后显红色
| ?
|
?
| ?
| ?
| ?
(5)为了提高原料的,老师建议把最后一步所得浅绿色滤液通过蒸发.冷却结晶.过滤.洗涤.自然干燥得到一种带结晶水的硫酸亚铁晶体。
研究小组按老 师的建议完成上面操作步骤,获得晶体后对其进行检测 师的建议完成上面操作步骤,获得晶体后对其进行检测
①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。研究小组通过计算测知该晶体的化学式是??????????????。
2、简答题 高锰酸钾是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.如图是实验室制备的操作流程:

上述反应②的化学方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3
已知:
| 物质 | K2CO3 | KHCO3 | K2SO4 | CH3COOK
293K溶解度(g)
111
33.7
11.1
217
(1)加热软锰矿、KClO3和KOH固体时,不采用瓷坩埚而选用铁坩埚的理由是______;反应①的化学方程式为______.
(2)从滤液中得到KMnO4晶体的实验操作依次是______(选填字母代号,下同).
a.蒸馏b.蒸发c.灼烧d.抽滤e.冷却结晶
(3)制备过程中需要用到纯净的CO2气体.制取纯CO2净最好选择下列试剂中______.
a.石灰石b.浓盐酸c.稀疏酸d.纯碱
(4)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.原因是______.
(5)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中______,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
3、实验题 (16分) I、实验室中常以BaSO4重量法测定BaCl2·nH2O中的Ba的含量主要步骤如下:
①???????灼烧瓷坩埚至恒重,称得坩埚的质量
② 称取BaCl2·nH2O并在烧杯中溶解,加盐酸处理
③ 将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④ 静置,????????????????????
⑤ 将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥ 计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_ ______(填“偏高”、“不变”或“偏低”)。 ______(填“偏高”、“不变”或“偏低”)。
(2)第④步静置后的操作是????????????????????。
(3)第⑤步灼烧温度不超过900℃,是因为_______________________。
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、 HSO3- 等阴离子中的若干种。
(4)写出氨水吸收过量SO2的反应的离子方程式:????????????????????????
(5)已知亚硫酸氢盐一般可溶于水。仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中。
实验操作
| 预期现象与结论
| 步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液。
| 若不出现浑浊,则溶液中不存在SO32-,
若出现浑浊,则溶液中可能含有SO32-。
| 步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中。往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入?????????????。
| ?
| 步骤3:
| ?
?
4、选择题 实验室里需要480mL 0.10mol/L的CuSO4溶液,以下操作正确的是(???)
A.称取12.5g胆矾(CuSO4·5 H2O),溶于500mL水配成溶液
B.称取12.0g胆矾(CuSO4·5 H2O),配成500mL溶液
C.称取1.0g CuSO4,配成500mL溶液
D.称取12.5g胆矾(CuSO4·5 H2O),配成500mL溶液
5、填空题 铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同.某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置.请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤.药品:稀硝酸、盐酸、Zn粒、CaCO3固体
(1)补充下面的实验:
步骤:
①检查装置的气密性;
②______;
③向试管中倒入过量稀硝酸并迅速盖上带铜丝和导管的橡皮塞;
④______;
⑤______;
⑥用注射器向试管内推入氧气(或空气).
(2)推入氧气或空气的目的是______.
(3)分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出这可能是Cu2+浓度差异引起的,你同意这种看法吗?______(填“同意”或“不同意”),原因是______,另一同学提出溶液呈“绿色”是Cu2+与NO2混合的结果,请你设计一个实验证明之(简述实验方案和实验现象)______.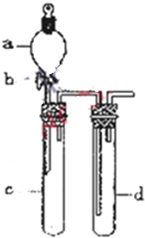
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772