微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
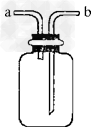
1、选择题 下图所示装置是化学实验室的常用装置,它有多种用途。以下各项用途和操作都正确的是?
 [???? ]
[???? ]
A.?干燥CO2:瓶内放一定体积浓硫酸,由a进气
B.?用于收集O2:瓶内充满水,由b进气
C.?提供少量CO:瓶内充满CO,b接进水管
D.?用做H2S和SO2反应的装置:由a通入H2S,b通入SO2 (已知:2H2S+SO2=3S↓+2H2O)
参考答案:C
本题解析:
本题难度:简单
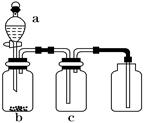
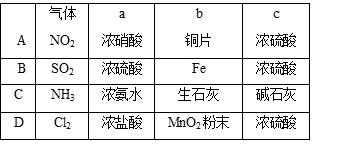
2、选择题 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的
试剂),其中可行的是?
 ?????????????????????????
?????????????????????????
参考答案:A
本题解析:
试题分析:B错误,因为铁在浓硫酸会钝化,不能用来制备二氧化硫;C错误,因为氨气的密度比空气小,不能采用向上拍空气法的方法收集;D错误,因为采用浓盐酸与二氧化锰反应制备氯气需要加热,所以答案为A。
点评:本题考查了具体气体的制备装置的选择,是高考考查的热点,本题有一定的综合性,难度适中。
本题难度:简单
3、实验题 (16分)
(I)氧化还原反应Cu+2AgNO3=Cu(NO3)2+2Ag可设计成一个原电池,
写出两个电极上的电极反应:负极:____________,正极:_____________。
(II)已知NaHCO3水溶液呈碱性:
(1)用离子方程式表示NaHCO3溶液呈碱性的原因__________________
(2) NaHCO3溶液中各离子的浓度由大到小的关系是________________
(III)某温度下,密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物质
| A
| B
| C
|
初始浓度/mol?L—1
| 0.020
| 0.020
| 0
|
平衡浓度/mol?L—1
| 0.016
| 0.016
| 0.0080
回答下列问题:
(1)反应达到平衡时,A的转化率为_____________。
(2)该反应的化学方程式可表示为(用A、B、C表示物质的化学式)
_____________________________,其平衡常数为_______________。
(3)该温度下,若将A和B各0.10mol的气体混合物充入10L的密闭容器中发生反应,10s末达到平衡,则用A表示的化学反应速率为____________________。
参考答案:(I)负极:Cu —2e—= Cu2+?????????正极
本题解析:(1)在原电池中较活泼的金属作负极,失去电子发生氧化反应,正极得到电子,发生还原反应。根据反应可知铜失去电子,Ag+得到电子,所以正负极的电极反应式为2Ag++2e—=2Ag、Cu —2e—= Cu2+。
(2)由于碳酸氢钠在溶液中既有电离平衡,还有水解平衡。电离显酸性,水解显碱性。因为水解程度大于电离程度,所以溶液显碱性。因为在溶液中水还可以电离出氢离子,因此溶液中各离子的浓度由大到小的关系是c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)。
(3)根据数据可知消耗A的浓度是0.020mol/L-0.016mol/L=0.004mol/L,所以A的转化率是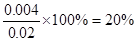 ;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g) ;又因为BC的浓度变化量分别是0.004mol/L、0.008mol/L,所以ABC的浓度变化量之比是1︰1︰2,故方程式为A(g)+B(g)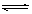 2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为 2C(g)。平衡常数是平衡时生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数为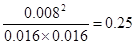 ;设A的转化量是x,则 ;设A的转化量是x,则
A(g)+B(g)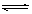 2C(g) 2C(g)
起始量(mol)?????????? 0.10??? 0.10??????? 0
转化量(mol)?????????? x???????? x???????? 2x
平衡量(mol)????????? 0.10-x??? 0.10-x???? 2x
根据平衡常数的表达式可知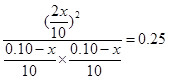
解得x=0.02。所以用A表示的化学反应速率为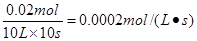 。 。
本题难度:一般
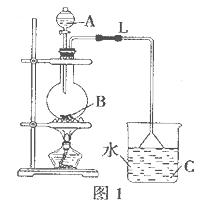
4、实验题 (14分)某研究性学习小组设计实验制各乙酸乙酯(如图1):
(1)制取乙酸乙酯化学方程式为:____________________.
(2)实验过程中,用酒精灯缓慢加热,“缓慢加热”目的是
(3)烧瓶B中加几块碎石片,其作用是__________。长导管L的作用是
(4)图1方案有明显缺陷,请提出改进建议:____________________.
经改进后,实验现象是______________________________.
简述分离乙酸乙酯的操作方法:___________________,需要用到的下列仪器有__________(填代号)。
参考答案:(1)CH3COOH+ CH3CH2OH 本题解析: 本题解析:
试题分析:(1)乙酸与乙醇在浓硫酸、加热条件下制取乙酸乙酯,化学方程式为CH3COOH+ CH3CH2OH CH3COOCH2CH3+H2O; CH3COOCH2CH3+H2O;
(2)乙酸、乙醇的沸点较低,易挥发,所以实验过程中,用酒精灯缓慢加热,“缓慢加热”目的是减少乙酸和乙醇的挥发,提高物质的转化率;
(3)加几块碎石片,其作用是防爆沸?;乙酸乙酯的沸点也比较低,为得到乙酸乙酯的液体,用长导管L的作用是冷凝兼导气;
(4)乙酸乙酯在饱和碳酸钠溶液中的溶解度最小,所以将C中的水改成饱和碳溶液;改进后,实验现象是C烧杯里液体分层,上层液体具有果香味、呈油状;溶液分层,所以需要分液将混合物分离,将C烧杯里液体混合物用玻璃棒引流注入分液漏斗里,静止、分层,打开分液漏斗活塞,将下层碳酸钠等无机层液体放入烧杯里,上层乙酸乙酯液体从上口倒出;需要用到的仪器有玻璃棒、烧杯、分液漏斗,答案选afg。
本题难度:一般
5、实验题 (15分)某研究小组用黄铜矿(主要成分是CuFeS2,其中S为-2价)为主要原料炼铜,其总反应为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。事实上该反应是按如下流程分步进行的:


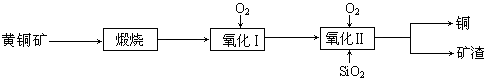
(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是?????(填化学式)。
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为?????。
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
沸腾炉温度/℃
| 560
| 580
| 600
| 620
| 640
| 660
| 水溶性Cu/%
| 90.12
| 91.24
| 93.50
| 92.38
| 89.96
| 84.23
| 酸溶性Cu/%
| 92.00
| 93.60
| 97.08
| 97.82
| 98.16
| 98.19
①CuFeS2与O2反应的化学方程式为?????。
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是?????。
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是?????。
④生成物冷却后的除铁的实验操作方法主要是?????。已知在溶液中,Cu2+开始沉淀和沉淀完全的pH分别为4.7、6.7,Fe3+开始沉淀和沉淀完全的pH分别为1.1、3.2;如果制得的硫酸铜溶液中含有少量的Fe3+,请写出除去溶液中Fe3+的实验操作步骤:?????。
参考答案:共15分
(1)FeSiO3(2分)
(2)4C
本题解析:
试题分析:(1)根据2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2,可得矿渣为FeSiO3;
(2)由题意可知,CuFeS2在酸性溶液中与氧气在一种细菌的作用下生成的硫酸盐是硫酸铜和硫酸铁,化学方程式为4CuFeS2+2H2SO4+17O2 4CuSO4+2Fe2(SO4)3+2H2O; 4CuSO4+2Fe2(SO4)3+2H2O;
(3)①精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,最终得CuSO4·5H2O,说明铁元素的存在形式是氧化铁,加水溶解可过滤除去,所以CuFeS2与O2反应的化学方程式为4CuFeS2+15O2=4CuSO4+2Fe2O3+4SO2
②因为CuFeS2与O2反应放热,所以在生产过程中控制加入CuFeS2的速度,控制温度;
③水溶性铜化合物为CuSO4?5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4?5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少;
④生成物中除硫酸铜外还有氧化铁,氧化铁不溶于水,所以冷却后的除铁的实验操作方法主要是过滤;除去铁离子而不除去铜离子,调节溶液的pH值在3.2到4.7之间,使铁离子完全沉淀,而铜离子不沉淀,所以具体操作是加入CuO[或Cu(OH)2或CuCO3]粉末,充分搅拌,调节溶液的pH约为3.2,加热煮沸,过滤,用(适量)稀硫酸酸化。
本题难度:一般
|
|