微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下集气装置中正确的是 (?????)???????
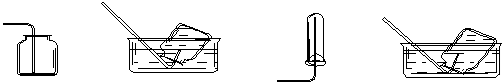
A.CO2的收集
B.NO的收集
C.O2的收集
D.NH3的收集
(液体为H2O)????????????????????????????(液体为H2O)
参考答案:AB
本题解析:
试题分析:CO2的密度大于空气的,所以应该用向上排空气法收集,A正确;NO极易被氧化生成NO2,所以只能用排水法收集,B正确;O2的密度大于空气的,所以应该用向上排空气法收集,C正确;氨气极易溶于水,应该用向下排空气法收集,D不正确,答案选AB。
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:一般
2、实验题 (13分)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去)。

试回答:
(1)上述实验中生成二氧化硫的反应的化学方程式为:??????????????????????????
(2)乙同学认为还可能产生氢气的理由:????????????????????????????????????
????????????????????????????????????????????????????????????。
(3)丙同学在安装好装置后,必不可少的一步操作是:????????????????????????。
(4)A中加入的试剂可能是____________,作用是_???????????????????????????;
B中加入的试剂可能是____________,作用是????????????????????????????;
E中加入的试剂可能是____________,作用是????????????????????????????。
(5)可以证明气体X中含有氢气的实验现象是:
C中:????????????????????????????,D中:??????????????????????????;
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?____________
(填“能”或“不能”);其原因是:?????????????????????????????????????。
参考答案:(13分)(每空1分)
(1) 本题解析:略
本题解析:略
本题难度:简单
3、选择题 有关下图所示装置的叙述不正确的是
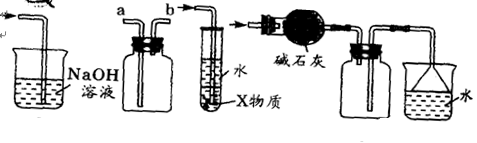
①???????????????②??????????③????????????????④
A.装置①可用于吸收实验中多余的Cl2
B.装置②可用于收集H2、NH3、Cl2、NO2等
C.装置③中X为汽油,可用于吸收氨气或氯化氢
D.装置④可用于收集NH3,并吸收多余NH3
参考答案:C
本题解析:
试题分析:氯气有毒,需要尾气处理,氢氧化钠溶液可以吸收氯气,A正确;B中收集氢气和氨气时从b口进入,收集氯气和NO2时从a口进入,因此选项B正确;汽油的密度小于空气的,在水的水层,C不正确,应该用四氯化碳;氨气的密度小于空气的,且极易溶于水,所以装置④可用于收集NH3,并吸收多余NH3,D正确,答案选C。
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力。
本题难度:简单
4、填空题 (14分)硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
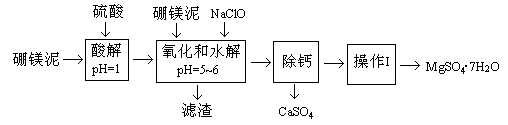
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有?????????。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有?????????。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式?????????。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为????????????????。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法?????????。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃)
| 40
| 50
| 60
| 70
|
MgSO4
| 30.9
| 33.4
| 35.6
| 36.9
|
CaSO4
| 0.210
| 0.207
| 0.201
| 0.193
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤?????????、?????????。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为?????????。
参考答案:(1)烧杯、100mL的容量瓶、胶头滴管?????????(
本题解析:
试题分析:1、配制溶液时还需要的玻璃仪器有烧杯、100mL的容量瓶、胶头滴管,
2、由于pH=5-6溶液呈酸性,所以滤渣中还有二氧化硅。
3、Mn2+与ClO-反应生成了MnO2沉淀H+和 Cl-。
Fe2+在酸性条件下被ClO-氧化为Fe3+、Cl-和 H2O。
4、取少量滤液,向其中加入硫氰化钾溶液,如果溶液不变红色,说明滤液中不含Fe3+;如果溶液变红色,说明滤液中含Fe3+。
5、观察图表可以知道两种物质随着温度的升高溶解度一种增大一种减小,可以利用溶解度的不同来分离。
6、根据元素守恒可以计算出硼镁泥中镁的质量,在计算出196.8 g MgSO4·7H2O中镁的质量就可以计算出其产率了。
点评:本题属于简单题,难度不大,但是知识点较多,做题时先分析图表,了解每一步的设计作用,再进行做题。
本题难度:一般
5、实验题 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
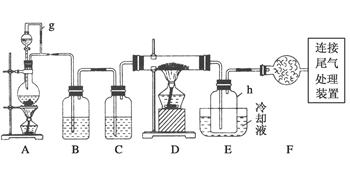
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质
| SiCl4
| BCl3
| AlCl3
| FeCl3
| PCl5
| 沸点/℃
| 57.7
| 12.8
| —
| 315
| —
| 熔点/℃
| -70.0
| -107.2
| —
| —
| —
| 升华温度/℃
| —
| —
| 180
| 300
| 162
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________________。
(2)装置A中g管的作用是________;装置C中的试剂是________;装置E中的h瓶需要冷却的理由是__________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
参考答案:(1)MnO2+4H++2Cl-△Mn2++Cl2↑+2H2
本题解析:略
本题难度:一般
|
|