微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 对于反应 2H2(g)+ O2(g)  ??2H2O(g);△H="-483.6" kJ/mol,下
??2H2O(g);△H="-483.6" kJ/mol,下 列说法正确的是
列说法正确的是
A.反应物具有的总能量高于生成物
B.H2的燃烧热△H=-241.8kJ/mol,
C.破坏H-H键要放出热量
D.升高温度重新达到平衡,平衡常数增大
参考答案:A
本题解析:略
本题难度:一般
2、选择题 下列物质中,既有离子键又有共价键的是???(????)
A.CaCl2
B.KOH
C.NH3·H2O
D.H2SO4
参考答案:B
本题解析:
试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,所以A中只有离子键,B中既有离子键,也要共价键。C、D中只有共价键,答案选B。
点评:该题是高考中的常见考点,属于基础性试题的考查。试题基础性强,侧重对化学键概念的考查,有利于培养学生灵活运用化学键知识解决实际问题的能力。
本题难度:一般
3、填空题 已知反应①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
FeO(s)+CO(g) ΔH=a kJ·mol-1,平衡常数为K;反应②CO(g)+1/2O2(g)===CO2(g) ΔH=b kJ·mol-1;测得在不同温度下,K值如下:
温度/℃
| 500
| 700
| 900
|
K
| 1.00
| 1.47
| 2. 40
(1)若500 ℃时进行反应①,CO2的起始浓度为2 mol·L-1,平衡时,CO的浓度为________。
(2)反应①为________(选填“吸热”或“放热”)反应。
(3)700 ℃时反应①达到平衡,要使该平衡向右移动且能增大CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.缩小反应器体积? B.通入CO2? C.升高温度到900 ℃?
D.使用合适的催化剂? E.增加Fe的量
(4)下列能说明反应②达到平衡状态的是________。
a.每消耗1 molCO的同时生成1 mol CO2? b.体系压强保持不变
c.v正(O2)=v逆(CO2)??? d.容器中混合气体的密度保持不变
e.混合气体中CO的体积分数保持不变??? f.CO和O2的体积比保持不变
参考答案:(1)? 1 mol·L-1????。???? (2) 吸热
本题解析:
试题分析:(1)设平衡时,CO的浓度为x,则根据平衡常数可知 ,解得x=1mol/L。 ,解得x=1mol/L。
(2)根据表中数据可知,随着温度的升高,K值是增大的,则升高温度,平衡向正反应方向移动,即正反应是吸热反应。
(3)反应①是体积不变的可逆反应,改变压强平衡不移动,A不正确;通入CO2平衡向右移动,但降低了
本题难度:一般
4、实验题
Ⅰ.已知测定中和热的实验步骤如下:①量取50mL 0.25 mol/L硫酸倒入小烧杯中,测量温度 ②量取50mL 0.55mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)NaOH溶液稍过量的原因 。
(2)加入NaOH溶液的正确操作是 (填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(3)使硫酸与NaOH溶液混合均匀的正确操作是 。
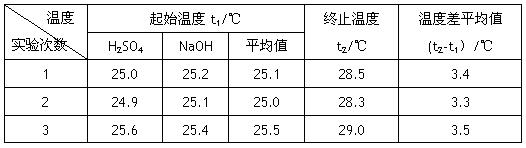
(4)设溶液的密度均为1g·cm-3,中和后溶液的比热容c="4.18" J·(g·℃)-1,请根据实验数据求出中和热为 写出该反应的热化学方程式_________
(5)若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量 (填“小于”、“等于”或“大于”)57.3 kJ,原因是
Ⅱ.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中用蒸馏水溶解
D.将物质的量浓度为M的标准硫酸溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
E.在锥形瓶下垫一张白纸,滴定至溶液恰好由红色变为无色时,记下读数为V2 mL
试填空:
(1)正确操作步骤的顺序是 (用字母表示)。
(2)观察滴定管液面的高度时应注意
(3)E步骤的操作中锥形瓶下垫一张白纸的作用是 。
(4)某学生实验时把锥形瓶用烧碱样品溶液洗涤,使测定的浓度_________(填“偏高”“偏低”或“无影响”),原因是
(5)该烧碱样品纯度的计算式为_________________________。
参考答案:Ⅰ、(1)确保硫酸被完全中和 (2)B
本题解析:略
本题难度:一般
5、选择题 下列关于化学反应的描述中正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.已知NaOH(aq) +HCI(aq) =NaCI(aq)+H2O(1)△H="-57.3" kJ·mol-1,
则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为
2CO(g)+O2(g)=2CO2(g)△H="-283.0" kJ·mol-1
D.已知2C(s) +2O2(g)=2CO2(g)△H=a,2C(s) +O2(g)=2CO(g)△H=b,则b>a
参考答案:D
本题解析:
试题分析:A、加热才能发生的反应不一定是吸热反应,如可燃物的燃烧反应都是放热反应,需要加热的条件,错误;B、醋酸是弱酸,反应时电离需要吸热,所以含40.0 g NaOH的稀溶液与稀醋酸完全中和时放出的热量少于57.3kJ,错误;C、燃烧热是指1mol的可燃物完全燃烧放出的热量,所以热化学方程式中CO的系数应是1,错误;D、等物质的量的C固体完全燃烧生成二氧化碳放出的热量大于生成CO放出的热量,但a、b都是负数,所以b>a,正确,答案选D。
考点:考查化学反应热效应的判断
本题难度:一般
|