微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应过程中,ΔH>0且ΔS>0的是
A.NH3(g)+HCl(g) NH4Cl(s)
NH4Cl(s)
B.CaCO3(s) CaO(s)+CO2(g)
CaO(s)+CO2(g)
C.4Al(s)+3O2(g) 2Al2O3(s)
2Al2O3(s)
D.HCl(aq)+NaOH(aq) NaCl(aq)+H2O(l)
NaCl(aq)+H2O(l)
参考答案:B
本题解析:本题主要考查焓变、熵变的判断,分解反应大多吸热,化合反应大多放热,燃烧、中和反应都是放热反应,同种物质固、液、气态时熵值依次增大。
本题难度:一般
2、选择题 下列属于放热反应的是
A.石灰石的分解
B.焦炭和二氧化碳共热
C.铝和盐酸反应
D.氯化铵与氢氧化钡反应
参考答案:C
本题解析:
试题分析:石灰石的分解、焦炭和二氧化碳共热、氯化铵与氢氧化钡反应为吸热反应,铝和盐酸反应为放热反应,故答案为C。
考点:本题考查化学反应的热效应。
本题难度:一般
3、填空题 (8分)某氮肥厂氨氮废水中氮元素多以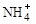 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下:
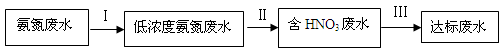
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下,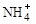 经过两步反应被氧化成
经过两步反应被氧化成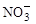 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下:
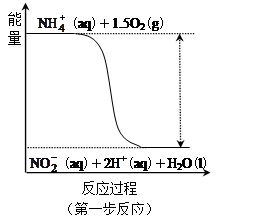
第一步反应是 反应(选填“放热”或“吸热”),判断依据是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
参考答案:(1) NH4++OH- 本题解析:
本题解析:
试题分析:(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用是H4++OH-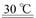 NH3↑+H2O;(2)根据图示可知:反应物的能量高三生成物的能量,所以当反应发生时多余的能量就释放出来,因此第一步反应是放热反应;(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,甲醇在反应中失去电子,作还原剂,而硝酸在反应中得到电子,作氧化剂,甲醇将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,每1mol的稀释在反应中得到5mol的电子。根据氧化还原反应中电子转移的数目相等可得:参加反应的还原剂和氧化剂的物质的量之比是5∶6。
NH3↑+H2O;(2)根据图示可知:反应物的能量高三生成物的能量,所以当反应发生时多余的能量就释放出来,因此第一步反应是放热反应;(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,甲醇在反应中失去电子,作还原剂,而硝酸在反应中得到电子,作氧化剂,甲醇将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,每1mol的稀释在反应中得到5mol的电子。根据氧化还原反应中电子转移的数目相等可得:参加反应的还原剂和氧化剂的物质的量之比是5∶6。
考点:考查离子方程式的书写、反应热与物质能量的关系、氧化还原反应中的概念和电子转移的关系的知识。
本题难度:一般
4、选择题 下列说法或表示方法正确的是
A.放热反应都不需要加热就能发生
B.由C(石墨)= C(金刚石);△H=+1.90 kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)= 2H2O(l); △H=-285.8kJ/mol
D.在稀溶液中,H+(aq)+ OH-(aq) = H2O(l); △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热大于57.3kJ
参考答案:D
本题解析:
试题分析:A错误,碳的燃烧,需要加热但是属于放热反应;B,△H大于0,所以C(金刚石)的能量大于石墨,所以金刚石比石墨不稳定;C错误,△H=-571.6kJ/mol;D正确,因为浓硫酸融水放出大量的热量,所以放出的热大于57.3kJ。
点评:本题考查了化学基本概念,是高考考查的热点,该题难度适中,是一道不错的题目。
本题难度:一般
5、选择题 下列说法正确的是
A.在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.31 kJ·mol-1。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
参考答案:B
本题解析:
试题分析:A中没有指明温度,错误;测定中和热是需要测量盐酸起始温度,NaOH起始温度和反应后终止温度,B对;燃烧热是指在25℃,101 kPa时,1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,1 mol C与适量O2反应生成1 mol CO时,没有完全燃烧,故放出的热量不是燃烧热,C错;浓硫酸溶解时要放出热量,故0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ,D错。
考点:燃烧热、中和热的定义的理解。
本题难度:一般