微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)将铂丝插入稀硫酸溶液作电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称作燃料电池。根据两极上反应的实质判断,通入甲烷的一极为电池的__????_极,通入氧气的一极的电极反应式为_______________,该燃料电池放电一段时间后溶液的浓度将__________(选填“增大”,“减小”或“不变”)
参考答案:负,? O2+4H++4e= 2H2O,?减小
本题解析:在原电池中负极失去电子,被氧化,发生氧化反应。正极得到电子,被还原,发生还原反应,所以在燃料电池中甲烷在负极通入,氧气在正极通入,电解质是稀硫酸,所以正极反应式为O2+4H++4e= 2H2O。应用燃料电池的生成物有水生成,即溶剂增加,所以硫酸浓度减小。
本题难度:一般
2、填空题 (10分)有如下两个反应
A:2HCl+Ba(OH)2=BaCl2+2H2O B:2Fe3++Cu=2Fe2++Cu2+
(1)根据两反应的本质,判断能否设计成原电池:A ,B ,(填“能”或“不能”)不能设计成原电池的原因是 ;
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池
①负极材料是 ,正极材料是 ,电解质溶液是 ;
②写出负极的电极反应式 ;
③若导线上转移电子0.2 mol,则负极质量减少 。
参考答案:(1)不能;能;没有电子的转移(每空1分)
(2)①C
本题解析:(1)由于电子的定向移动,形成电流,所以只有氧化还原反应才能设计成原电池。A中中和反应,不能设计车原电池。B是氧化还原反应,可以设计成原电池。
(2)根据反应式可知,铜失去电子,所以铜是负极。铁离子得到电子,因此电解质溶液应该是可溶性的铁盐。电极反应式分别是负极:Cu-2e-=Cu2+,正极:2Fe3++2e=2Fe2+。根据电极反应式可知当转移0.2mol电子时,消耗的铜是0.1mol,质量是6.4g。
本题难度:一般
3、选择题 A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C金属的活动性顺序为 ( )
A.A>B>C B.A>C>B C.B>A>C D.B>C>A
参考答案:C
本题解析:
试题分析:把A浸入C的硝酸盐溶液中,A的表面有C析出;说明金属A可以把金属C从其盐中置换出来,所以活泼性A>C,A、B和稀硫酸组成原电池时,B为电池的负极,所以活泼性B>A,A、B、C三种金属的活动性顺序为B>A>C。
故选C。
考点:常见金属的活动性顺序及其应用 原电池和电解池的工作原理
点评:本题考查判断金属活泼性的方法,可以根据所学知识进行回答,难度不大。
本题难度:一般
4、选择题 某同学利用家中废旧材料制作一个可使玩具扬
声器发出声音的电池,装置如右图所示。下列
说法正确的是??????????????????????????????????(???)
A.电流方向为:
铝质易拉罐→导线→扬声器→导线→炭棒
B.铝质易拉罐将逐渐被腐蚀
C.电池总反应为:4Al+3O2+6H2O=4Al(OH)2
D.炭棒上发生的主要反应为:2H++2e-=H2↑
参考答案:BC
本题解析:略
本题难度:一般
5、选择题 用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是? ( )
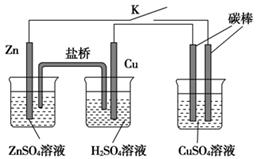
A.铜棒为正极,其电极反应式为:2H++2e-====H2↑
B.烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C.反应中消耗锌的质量为13 g
D.导线中通过电子的物质的量为0.2 mol
参考答案:C
本题解析:
试题分析:A、锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子放电,A正确;B、烧杯右侧碳棒与电源的负极相连为阴极,溶液中的铜离子放电,其电极表面有红色物质析出,B正确;C、反应一段时间后断开K,向右侧烧杯中加入0.1 mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH,这说明惰性电极电解硫酸铜溶液时阳极是氢氧根放电产生氧气,阴极是铜离子放电析出铜,电极反应式分别为4OH--4e-=2H2O+O2↑、2Cu2++4e-=2Cu。根据原子守恒可知,析出铜的物质的量是0.1mol,则反应中转移电
本题难度:一般