微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
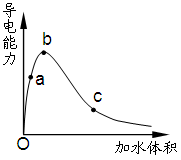
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
参考答案:BC
本题解析:根据溶液的导电能力可知,氢离子浓度由大到小的顺序是bac,所以pH由大到小的顺序是cab,A不正确;稀释促进电离,选项B正确;pH试纸如果事先润湿,则相当于稀释醋酸,由于a点随溶液的稀释氢离子浓度是增大的,所以pH会减小,C正确;醋酸在稀释过程中,醋酸的物质的量是不变的,中和氢氧化钠的能力是不变的,D不正确,答案选BC。
本题难度:一般
2、填空题 (5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
酸
| c(一元酸) /mol·L–1
| c(NaOH) /mol·L–1
| 混合溶液的pH
|
HX
| 0.1
| 0.1
| pH = x
|
HY
| 0.1
| 0.1
| pH = 7
|
HZ
| 0.1
| 0.1
| pH = 9
(1)上述三种酸中一定属于强酸的是???,
(2)HZ和NaOH发生反应的离子方程式为???,所得溶液中pH大于7的原因是???(用化学方 程式表示)。
(3)HX反应后所得溶液中,由水电离产生的c(OH-)=???mol·L-1,下列叙述是对x 值的判断,其 中正确的是???。
A.一定=7?? B.可能<7??? C. 一定≧7??? D.一定>7
参考答案:(5分)(1)HY?????
(2)HZ +OH- =
本题解析:
试题分析:(1)等物质的量的酸与氢氧化钠混合,溶液的酸碱性取决于酸的强弱,若酸是强酸,则溶液呈中性,若酸是弱酸,则溶液呈碱性,所以上述三种酸中一定属于强酸的是HY;
(2)从HZ与氢氧化钠混合液的pH判断HZ是弱酸,酸性离子方程式时不能拆成离子形式,所以离子方程式为HZ +OH- ="=" H2O + Z-,所得溶液中pH大于7的原因是因为Z-水解使溶液呈碱性,水解的离子方程式为H2O + Z- 本题难度:一般 本题难度:一般
3、选择题 化学中常借助图象来表示某种变化过程,下列关于4个图象的说法正确的是( )
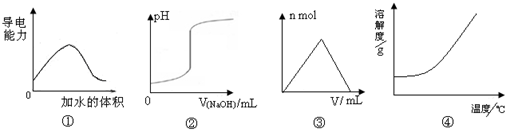
A.图①可表示t℃时,冰醋酸稀释过程中溶液导电性的变化
B.图②可表示向一定量盐酸中滴加一定浓度氢氧化钠溶液时,溶液pH的变化
C.图③可表示向一定量明矾溶液中滴加一定浓度氢氧化钡溶液时,产生沉淀的物质的量的变化
D.图④可表示所有的固体物质溶解度随温度的变化
参考答案:A.溶液导电性强弱取决于溶液中离子浓度的大小,纯净的醋酸不存
本题解析:
本题难度:一般
4、选择题 电解质溶液的酸度(用AG表示)定义为c(H+)与 C(OH-)比值的对数,即AG=lg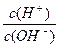 。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是(??? ) 。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是(??? )
A.Mg2+、Ca2+、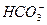 、Cl- 、Cl-
B.K+、I-、 、Br- 、Br-
C.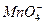 、Ca2+、Cl-、 、Ca2+、Cl-、
D.Na+、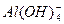 、Cl-、 、Cl-、
参考答案:B
本题解析:由AG=12,可推出溶液中c(H+)=1×10-1 mol·L-1,溶液呈酸性。选项A中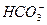 不能与H+大量共存;选项C中 不能与H+大量共存;选项C中
本题难度:简单
5、选择题 50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol?L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1
参考答案:C
本题解析:由溶液 pH计算表达式可得,c(H+)=10-pHmol/L,则pH=4的醋酸中c(H+)=10-4 mol?L-1,A项错误;小苏打的化学式是NaHCO3,属于钠盐、酸式盐,在水中能完全电离,即NaHCO3="=" Na++HCO3-,钠离子不能水解,而HCO3-不仅少部分水解生成碳酸,还有少部分HCO3-电离出碳酸根离子,即HCO3-+H2O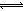 H2CO3+OH-、HCO3- H2CO3+OH-、HCO3-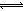 H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+ c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O H++CO32-,且其水解程度大于电离程度,则饱和小苏打溶液中:c(Na+)>c(HCO3-),B项错误;饱和食盐水中溶质为NaCl、溶剂为H2O,前者全部电离为Na+、Cl-,后者部分电离为OH-、H+,根据电荷守恒原理可得:c(Na+)+ c(H+)= c(Cl-)+c(OH-),C项正确;25℃时Kw= c(H+)?c(OH-)=1.0×10-14,水的电离是吸热反应,升高温度能促使H2O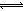 H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。 H++OH-的电离平衡右移,则50℃时Kw= c(H+)?c(OH-)>1.0×10-14,pH=12的纯碱溶液中c(H+)=10-pHmol/L=10-12mol/L,c(OH-)= Kw/ c(H+)>1.0×10-2molL-1,D项错误。
【学科网考点定位】本题考查考生对溶液pH的了解;考查考生对盐类水解、弱电解质在水中的电离的了解;考查考生对水溶液中离子浓度大小的比较;考查考生对水的电离平衡和离子积常数的了解;考查考生对温度与平衡常数大小关系的了解。
本学科网解析为学科网名师学科网解析团队原创,授权学科网独家使用,如有盗用,依法追责!
二、双项选择题:本大题共2小题,每小题6分,共12分。在每小题给出四个选项中,有两个选项符合题目要求,全部选对的得6分,只选1个且正确的得3分,有选错或不答的得0分。
本题难度:一般
|