微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列性质中,不能说明乙酸是弱电解质的是
①乙酸溶液能导电
②常温时,0.1mol/L乙酸溶液的PH约为3
③乙酸能和碳酸钙反应放出CO2
④10mL 1mol/L乙酸溶液与10mL 1mol/L的NaOH溶液恰好完全反应
⑤同PH的盐酸和乙酸分别与足量铁片反应,乙酸产生H2多
⑥PH=1的醋酸溶液用水稀释1000倍后,pH<4
A.①②③
B.④⑤⑥
C.①③④⑤
D.②③④
参考答案:无答案
本题解析:
试题分析:①强弱电解质在一定条件下都可以导电,所以选;②若是强电解质,则完全电离,HP=1,所以能说明,不选;③能反应只能说明酸性比碳酸强,不能说明就是强电解质,选;④不论是否完全电离,都是一比一反应,所以不能说明,选;⑤相同PH时,放出氢气多,说明开始的时候并未完全电离,说明是弱电解质,不选;⑥若是强电解质,稀释后PH=4,能说明是弱电解质,不选。
考点:考查化学与能量的相关知识点
本题难度:一般
2、选择题 下列实验过程中产生的现象与对应图形相符合的是( )
A.
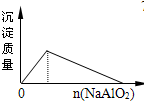
向盐酸中加入NaAlO2溶液
B.
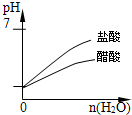
pH=1的醋酸和盐酸分别加等量水稀释
C.
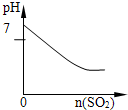
SO2气体通入溴水中
D.
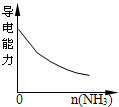
氨气通入醋酸溶液中
参考答案:A.在盐酸溶液中加入NaAlO2,发生反应分别为AlO2-+
本题解析:
本题难度:简单
3、填空题 (8分)在6份0.01 mol·L-1氨水中分别加入下列各物质:
A.浓氨水
B.纯水
C.少量K2CO3固体
D.少量浓H2SO4
E.少量NaOH固体 F.少量Al2(SO4)3固体
(1)能使c(OH-)减小、c(NH4+)增大的是 ;
(2)能使(OH-)增大、c(NH4+)减小的是 ;
(3)能使c(OH-)和c(NH4+)都增大的是 ;
(4)能使c(OH-)和c(NH4+)都减小的是 。
参考答案:(1)DF (2)CE&
本题解析:氨水中存在电离平衡NH3·H2O NH4++OH-,根据勒夏特列原理可知,A降低氨水的电离程度,但溶液中c(OH-)和c(NH4+)都增大。纯水增大氨水的电离程度,但c(OH-)和c(NH4+)都减小。K2CO3固体溶于水水解显碱性,NaOH固体溶于水电离出OH-,抑制氨水的电离。浓硫酸能中和OH-,促进电离,同样Al2(SO4)3固体溶于水能结合OH-,促进电离。
NH4++OH-,根据勒夏特列原理可知,A降低氨水的电离程度,但溶液中c(OH-)和c(NH4+)都增大。纯水增大氨水的电离程度,但c(OH-)和c(NH4+)都减小。K2CO3固体溶于水水解显碱性,NaOH固体溶于水电离出OH-,抑制氨水的电离。浓硫酸能中和OH-,促进电离,同样Al2(SO4)3固体溶于水能结合OH-,促进电离。
本题难度:一般
4、选择题 在体积均为1L,pH均等于2的盐酸和醋酸溶液,分别投入0.23g Na,则下图中比较符合反应事实的曲线是(????)
参考答案:B
本题解析:
试题分析:pH均等于2的盐酸和醋酸溶液,起始氢离子浓度相同,但醋酸为弱酸,醋酸的浓度远大于盐酸的浓度,与等量的Na反应时,醋酸的电离平衡正向移动,醋酸中氢离子浓度大于盐酸中氢离子浓度,醋酸反应速率快;由题给数据结合反应方程式判断,醋酸远过量,盐酸恰好反应。A、醋酸与Na反应生成醋酸钠溶液,因醋酸根离子水解显碱性,但醋酸远过量,反应后溶液显酸性,溶液的pH<7,盐酸与Na恰好完全反应生成氯化钠,则反应后溶液的pH=7,错误;B、因盐酸与Na恰好完全反应,则反应后溶液的pH=7,醋酸与Na反应生成醋酸
本题难度:一般
5、选择题
A.自来水
B.0.5 mol·L-1盐酸
C.0.5 mol·L-1 CH3COOH溶液
D.0.5 mol·L-1 KCl溶液
参考答案:B
本题解析:溶液混合后导电能力变化的大小,关键看混合后溶液中自由移动离子的浓度的变化。由于自来水几乎不导电,加入0.05 mol NaOH后,导电性突然增大;醋酸是弱电解质,加入NaOH后,生成强电解质CH3COONa,导电性明显增强;0.5 mol·L-1的KCl中加入0.05 mol NaOH固体后,离子浓度增大,导电能力增强;只有0.5 mol·L-1的盐酸,能与NaOH反应生成强电解质NaCl,不影响导电性。
本题难度:简单