微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质的电子式书写正确的是( )
A.Na2O
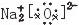
B.H2S
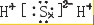
C.H2O2
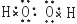
D.N2

参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法正确的是[???? ]
A.某微粒核外电子排布为2,8,8结构,则该微粒一定是氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.F-,Na+,Mg2+,Al3+是与Ne原子具有相同电子层结构的离子
D.NH3与H3O+具有相同的质子数和电子数
参考答案:CD
本题解析:
本题难度:简单
3、填空题 在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是___________
(2)以极性键相结合,具有直线型结构的非极性分子是___________
(3)以极性键相结合,具有正四面体结构的非极性分子是___________
(4)以极性键相结合,具有三角锥型结构的极性分子是___________
(5)以极性键相结合,具有折线型结构的极性分子是_________
(6)以极性键相结合,而且分子极性最大的是__________
参考答案:(1)N2
(2)CS2
(3)CH4
(
本题解析:
本题难度:一般
4、实验题 现有两种配合物晶体[Co(NH3)6]Cl3和[Co(NH3)5 Cl]Cl2,一种为橙黄色,另一种为紫红色。请设计实验方案将这两种配合物区别出来。
参考答案:称取相同质量的两种晶体分别配成溶液,向两种溶液中分别滴加足量
本题解析:[Co(NH3)6]Cl3和[Co(NH3)5 Cl]Cl2两种配合物晶体是同分异构体,组成元素和响应个数完全相同,但结构却不同。在[Co(NH3)6]Cl3中Co3+与6个NH3分子配合成[Co(NH3)6]3+,3个Cl-都是外界离子。[Co(NH3)5 Cl]Cl2中Co3+与5个NH3分子和一个Cl-配合成[Co(NH3)5 Cl]2+,只有2个Cl-是外界离子。由于配合物中内界以配位键结合很牢固,难以在溶液中电离,而内界和外界之间以离子键结合,在溶液中能够完全电离。不难看出,相同质量的两种晶体在
本题难度:一般
5、填空题 金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)写出Ti基态原子的电子排布?????????????????。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C???B(选填“>”“<”),第一电离能N>O,原因是???????????。
(3)月球岩石玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为?????,其中硫原子采用?????杂化,氧原子的价电子排布图为???????,任意写出一种SO42-等电子体?????。
(4)将TiOSO4的稀溶液加热水解后,经进一步反应,可得到钛的某种氧化物。该氧化物的晶胞结构图如图所示。
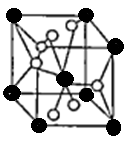
则该氧化物的化学式??????(图中钛原子用“O”表示。氧原子用“O”表示)
参考答案:(1)1s22s22p63s23p63d24s2
(2
本题解析:(1)Ti是22元素,核外电子排布式是1s22s22p63s23p63d24s2
(2)非金属性越强,电负性越大,所以电负性C大于B;N原子2p上处于半充满状态,比较稳定,所以第一电离能N>O;
(3)SO42-是AB4型,原子的孤对电子对数是(6+2-4×2)/2=0,所以立体构型是正四面体,采取sp3杂化;氧原子价电子是6,其价电子排布图是,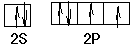 本题难度:一般
本题难度:一般